
精彩内容
“突破性疗法”是继快速通道、加速批准、优先审评后,FDA创建的又一个新药评审通道,旨在加速开发及审查治疗严重的或威胁生命的疾病的新药。据米内网数据,全球被授予“突破性疗法”认证且获批上市的新药共110个,其中有21个新药在2018年全球销售额超过10亿美元。那么这21个重磅产品在国内上市及销售情况如何?有哪些药企已着手布局仿制药/生物类似药?
表1:被授予“突破性疗法”认证且全球销售额超过10亿美元的产品
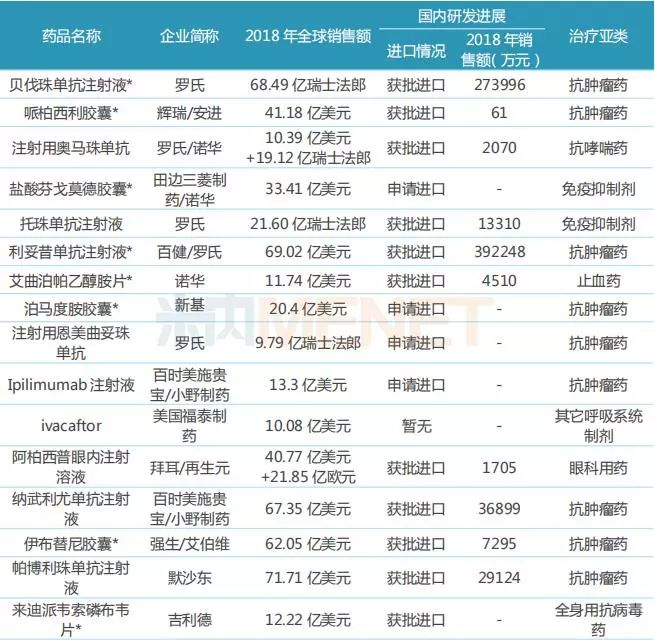
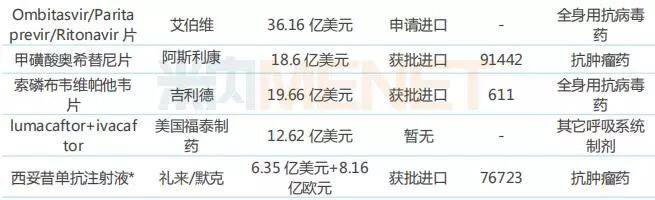
注:带*代表已有国内药企布局;国内销售额指中国公立医疗机构加城市零售药店销售额,下同。(来源:米内网数据库)
“突破性疗法”认证被认为给无药可医或濒临危重的患者带来了福音,获得该认证的药物在开发上能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。据米内网全球药物研发库,截至目前,全球被授予“突破性疗法”认证且获批上市的新药共110个,其中有21个新药在2018年全球销售额超过10亿美元。
从21个产品的药物类型看,小分子治疗药与生物药不分伯仲;从药物的治疗类别看,抗肿瘤药物占据“半壁江山”,可见相比于其他治疗类别药物,抗肿瘤药物更受益于“突破性疗法”认证;21个产品中有14个已在国内获批进口,5个处于申请进口阶段;9个产品已有国内药企布局生物类似药或仿制药。
贝伐珠单抗注射液
齐鲁、信达争夺首个生物类似药
图1:2015-2018年贝伐珠单抗注射液国内外销售情况
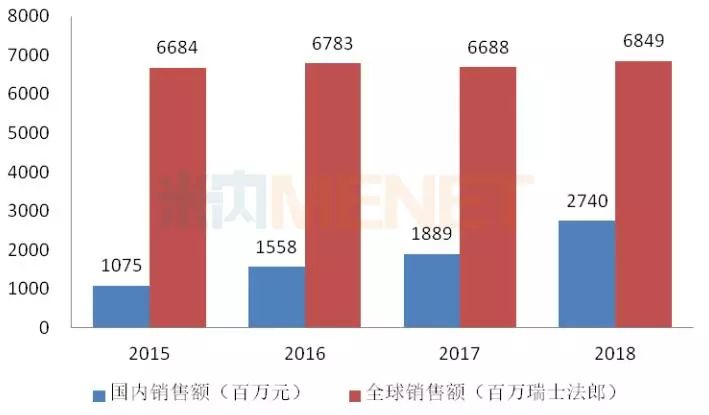
(来源:米内网数据库)
贝伐珠单抗,由罗氏子公司基因泰克研发,最早于2004年2月26日获得FDA批准,用于治疗转移性结直肠癌。虽然贝伐珠单抗生物类似药已于美国和欧盟获批上市,但其在2018年仍实现68.49亿瑞士法郎的销售收入;贝伐珠单抗于2010年获得国家药监局批准进入中国市场,近几年来,该产品在国内市场(中国公立医疗机构终端+城市零售药店终端,下同)的销售额突飞猛进,2017年通过谈判以降幅近60%进入医保目录,2018年实现销售额27.4亿元。
表2:申报上市及处于临床III期的贝伐珠单抗生物类似物
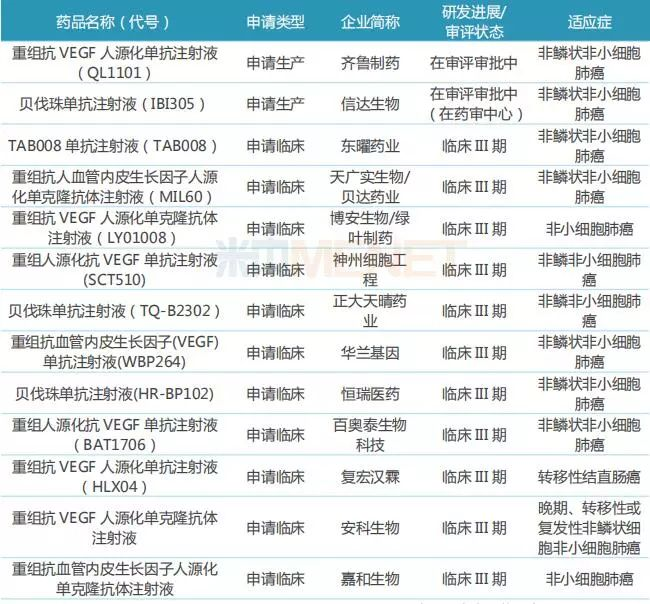
(来源:米内网数据库)
贝伐珠单抗在中国的专利保护于2018年到期,目前国内尚无贝伐珠单抗类似物上市,但已有近30家药企着手布局。齐鲁制药与信达生物的产品已提交上市申请,争夺首个贝伐珠单抗生物类似药;正大天晴、复宏汉霖、百奥泰、恒瑞等企业的产品已进行到临床III期。
哌柏西利胶囊
齐鲁有望获得首仿并视同通过一致性评价
图2:2015-2018年哌柏西利胶囊国内外销售情况

(来源:米内网数据库)
哌柏西利是辉瑞研发的首个CDK4/6抑制剂,于2015年2月获得FDA批准上市,该产品上市后全球销售额增长迅猛,近3年来年增长率均达2位数,2019年有望突破50亿美元。哌柏西利于2018年7月获得国家药监局批准进口,用于治疗激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌,2018年实现销售额61万元。
表3:哌柏西利胶囊国内研发情况
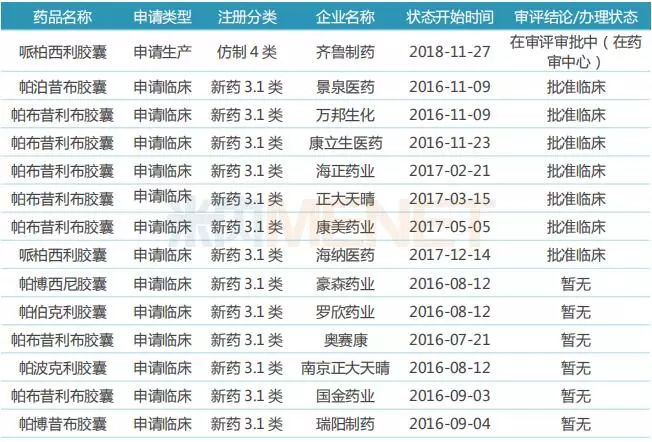
(来源:米内网MED中国药品审评数据库2.0)
目前国内已有14家药企针对哌柏西利胶囊提交生产或临床申请,齐鲁制药的产品按仿制4类申报上市,有望首个获批上市并视同通过一致性评价;海正药业、正大天晴等7家药企的产品按新药3.1类申报临床,目前已获批临床;豪森药业、罗欣药业等6家药企的产品按新药3.1类申报临床,目前还没有审评结论。
盐酸芬戈莫德胶囊
原研还在申请进口,国内药企已抢先布局
图3:2013-2018年盐酸芬戈莫德胶囊全球销售情况
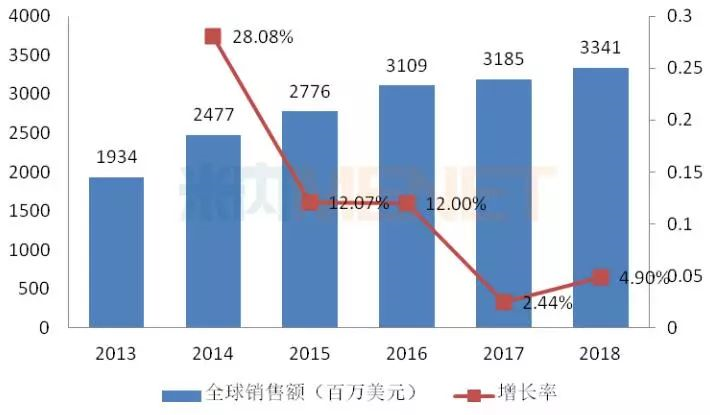 (来源:米内网跨国公司业绩库)
(来源:米内网跨国公司业绩库)
芬戈莫德是诺华和日本三菱制药共同研发的全球首个可口服给药治疗多发性硬化症(MS)的药物,最早于2010年9月获得FDA批准上市,近几年来,该产品在全球的销售额呈现稳步增长态势。目前芬戈莫德还未在国内上市,原研厂家诺华于2013年5月拿到该产品临床批件,2019年4月提交的进口申请获得CDE承办受理,目前处于“在审批”状态,有望于本月获批进口。
表4:芬戈莫德国内研发进展
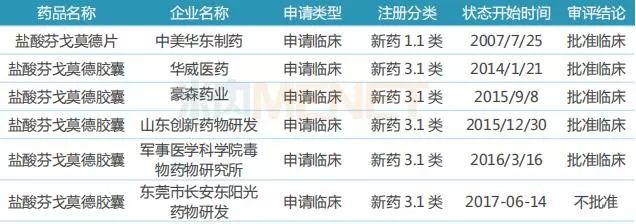

(来源:米内网MED中国药品审评数据库2.0)
虽然原研厂家的产品还未获批进口,但国内药企已抢先布局,中美华东制药的盐酸芬戈莫德片以新药1.1类申报临床,目前已获批临床;豪森药业、华威医药等7家药企的产品以新药3.1类申报临床,其中4家药企获批临床。
利妥昔单抗注射液
复星斩获首个生物类似药,信达紧接其后
图4:2015-2018年利妥昔单抗注射液国内外销售情况
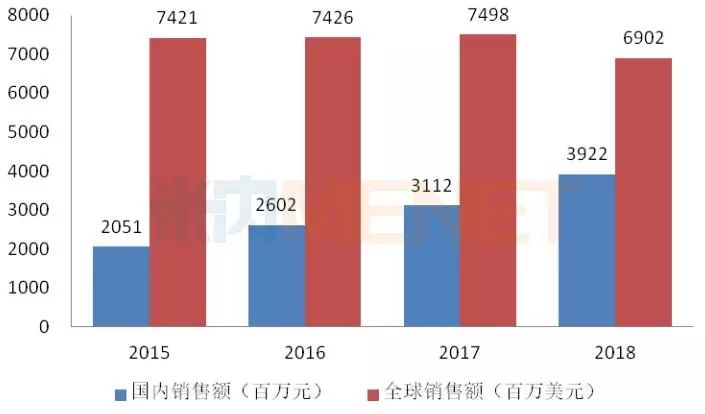
(来源:米内网数据库)
利妥昔单抗由罗氏研发,最早于1997年获得FDA批准上市,随着专利到期及生物类似药获批上市,该产品2018年全球销售额开始下滑。反观国内市场,利妥昔单抗获批进口后销售额逐年上涨,2017年通过谈判纳入国家医保,2018年在国内的销售额已接近40亿元。
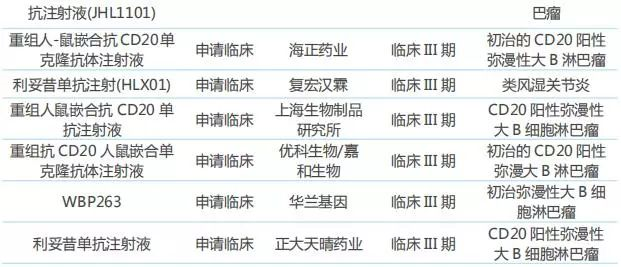
表5:已上市/申报上市/处于临床III期的利妥昔单抗生物类似物

(来源:米内网数据库)
目前国内市场有近20家药企布局利妥昔单抗生物类似物,复星医药的产品已于2019年2月获得国家药监局批准上市,用于治疗非霍奇金淋巴瘤,成为我国首个上市的利妥昔单抗生物类似药。6月27日,信达生物的IBI301的上市申请获得国家药监局受理,此外海正药业、正大天晴等药企的产品已进行到临床III期。
艾曲泊帕乙醇胺片
武汉药谷生物抢尽先机
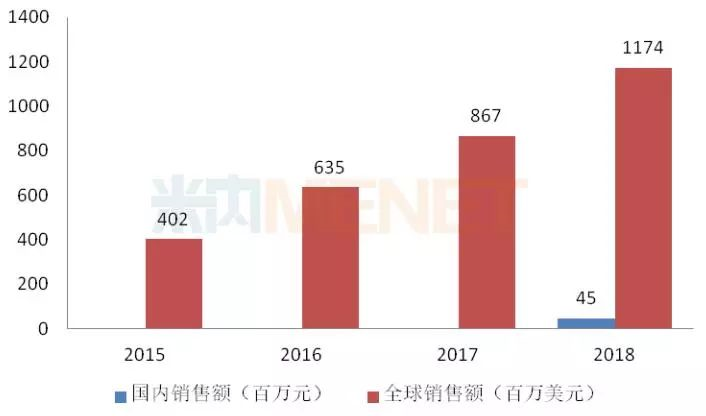
图5:2015-2018年艾曲泊帕乙醇胺片全球及国内销售情况
(来源:米内网数据库)
艾曲泊帕乙醇胺最早由葛兰素史克研发,于2008年11月获得FDA批准上市,2015年3月葛兰素史克与诺华进行资产置换,诺华将该产品收入囊中。近几年来,艾曲泊帕乙醇胺全球销售额以2位数的增长率快速上涨,2018年11月新适应症获得FDA批准,成为十年来首个再生障碍性贫血新药。2018年7月,艾曲泊帕乙醇胺获得国家药监局批准进口,用于原发免疫性血小板减少症(ITP)患者的血小板减少,2018年在国内的销售额达4510万元。
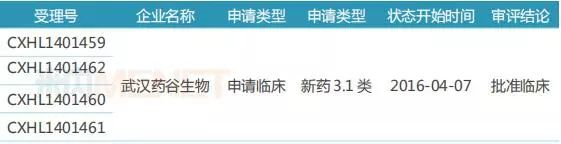
表6:艾曲泊帕乙醇胺片国内研发进展
(来源:米内网MED中国药品审评数据库2.0)
目前国内市场仅1家药企针对艾曲泊帕乙醇胺片提交临床申请,2014年11月,武汉药谷生物以新药3.1类提交的临床申请获得CDE承办受理,2016年4月获批临床。
泊马度胺胶囊
正大天晴有望获得首仿,视同通过一致性评价
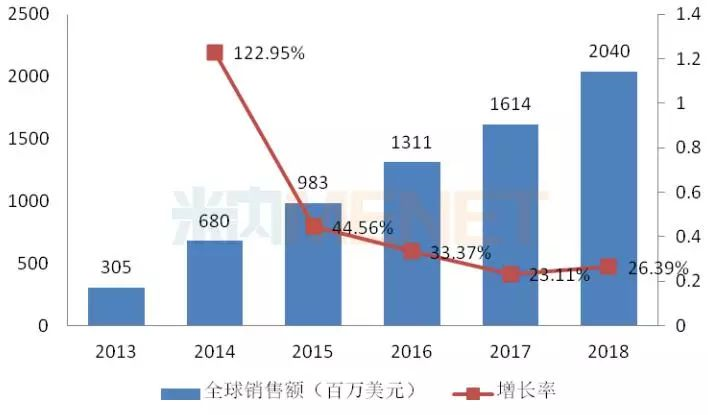
图6:2013-2018年泊马度胺胶囊全球销售情况
(来源:米内网跨国公司业绩库)
泊马度胺胶囊最早于2013年2月获得FDA批准上市,用于治疗多发性骨髓瘤,2018年全球销售额突破20亿美元。目前该产品还未在国内上市,新基于2013年11月提交临床申请获得CDE承办受理,2015年12月获批临床。
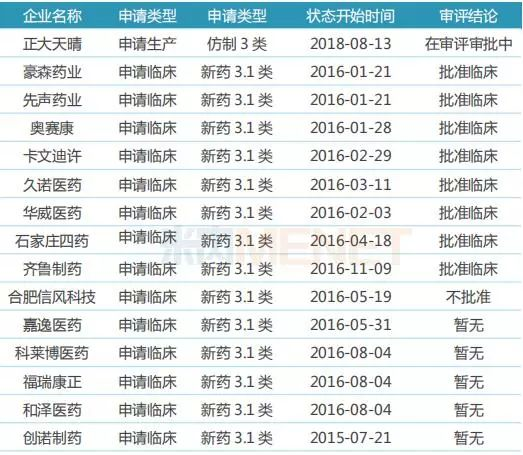
表7:泊马度胺胶囊国内研发进展
(来源:米内网MED中国药品审评数据库2.0)
虽然原研产品还未获批进口,但目前已有15家药企布局泊马度胺胶囊仿制药,正大天晴药业的产品进展最快,目前已按仿制药3类提交上市申请,有望首个获批上市并视同通过一致性评价;豪森药业、先声药业等8家药企的产品已获批临床。
西妥昔单抗注射液
科伦、迈博太科谁将率先报产?
图7:2014-2018年西妥昔单抗注射液全球及国内销售情况

(来源:米内网数据库)
西妥昔单抗由Imclone公司与BMS联合开发,于2003年12月首次在瑞士上市,2004年12月获得FDA批准上市,用于治疗晚期结直肠癌,默克获得该产品在北美以外的销售权。西妥昔单抗于2006年获得国家药监局批准进入中国市场,2008年礼来出资65亿美元收购了imclone。西妥昔单抗专利已经到期,2018年全球销售额有所下滑,在国内市场的销售成绩也不是特别惊艳,2018年实现销售额为7.67亿元。
表8:处于临床III期的西妥昔单抗生物类似药

(来源:米内网数据库)
目前国内市场有超过10家药企布局西妥昔单抗生物类似药,暂时未有企业提交上市申请,四川科伦、迈博太科药业的产品均已进行到临床III期。
伊布替尼胶囊
8家药企的产品获批临床
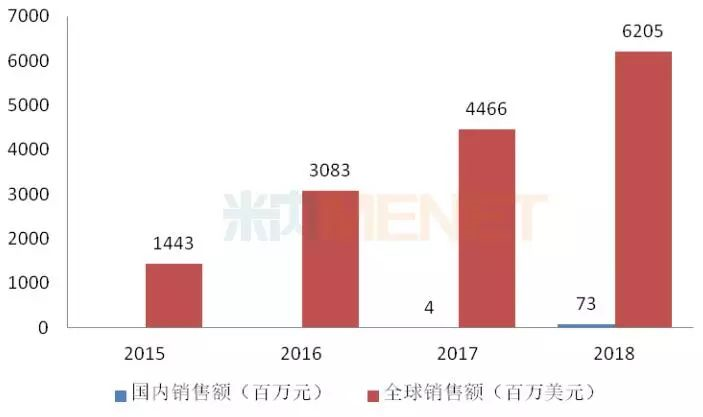
图8:2015-2018年伊布替尼胶囊全球及国内销售情况
(来源:米内网数据库)
伊布替尼胶囊由强生、艾伯维联合开发,最早于2013年11月获得FDA批准上市,用于治疗慢性淋巴细胞白血病,其全球销售额近几年来增长迅猛。该产品于2017年8月获得国家药监局批准进口,2018年在国内的销售额为7295万元。
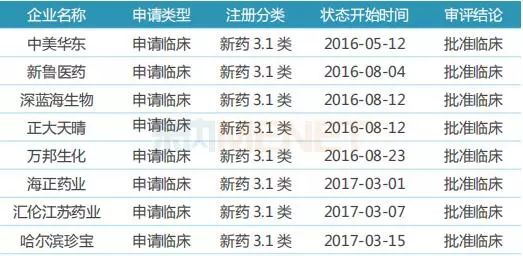
表9:依鲁替尼胶囊(伊布替尼胶囊)国内研发情况
(来源:米内网MED中国药品审评数据库2.0)
目前国内市场有8家药企以新药3.1类提交依鲁替尼胶囊(伊布替尼胶囊)提交临床申请,目前均已获批临床。
来迪派韦索磷布韦片
原研产品销售额下滑,国内3家药企布局
图9:2014-2018年来迪派韦索磷布韦片全球销售情况

(来源:米内网跨国公司业绩库)
来迪派韦索磷布韦是由吉利德研发的丙肝治疗药物,最早于2014年获得FDA批准上市,2015年即实现全球超百亿美元的销售收入,之后销售额开始下滑。该产品于2018年12月获得国家药监局批准进入国内市场。
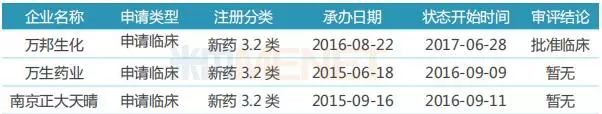
表10:来迪派韦索磷布韦片国内研发情况
(来源:米内网MED中国药品审评数据库2.0)
目前国内已有3家药企按新药3.2类提交来迪派韦索磷布韦片临床申请,其中万邦生化的产品已经获批临床。
来源:米内网数据库
注:数据统计截至7月12日,如有疏漏,欢迎指正!