
精彩内容
日前,广东东阳光药业按仿制药4类申报的替格瑞洛片以“同一生产线生产,申请国内上市的仿制药”为由拟纳入优先审评,有望加速上市。截至目前,东阳光药业已有31个受理号(涉及15个品种)纳入优先审评,借力优先审评,公司有13个仿制药或将加速通过一致性评价。2018年,东阳光药业在美国斩获14个ANDA,通过“国外转报国内”的方式,公司已有4个品种视同通过一致性评价,此外还有17个仿制药按新注册分类提交上市申请,2019年公司一致性评价品种将迎爆发期。
5亿品种近40家企业布局,东阳光药攀上“捷径”
2月3日,在CDE新公示的拟优先审评品种中,广东东阳光药业的替格瑞洛片赫然在列,纳入理由为“同一生产线生产,申请国内上市的仿制药”,该产品于2018年7月20日获得FDA批准上市,2018年10月10日,广东东阳光药业按仿制药4类提交的替格瑞洛片的上市申请获得CDE承办受理,受理号为CYHS1800302、CYHS1800303,目前处于“在审评审批中(在药审中心)”状态。
替格瑞洛是一种新型的、具有选择性的小分子抗凝血药,是第一个可逆结合、直接起效、口服给药的新型P2Y12受体拮抗剂,临床上主要用于心、脑血管血栓事件的预防和治疗,目前已被10部国际治疗指南推荐用于急性冠脉综合征患者的治疗。
由阿斯利康研发的替格瑞洛片于2010年12月首次在欧洲获批上市;2011年7月获得FDA批准上市,商品名为Brilinta;2012年12月获得国家药监局批准上市,商品名为倍林达。
图1:2013-2017年替格瑞洛片全球及国内销售情况
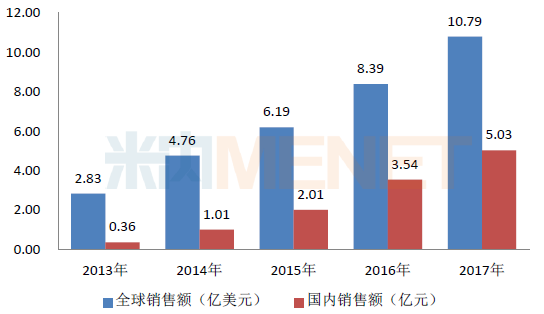
注:国内销售额指中国公立医疗机构终端销售额
(来源:米内网数据库)
据米内网数据,阿斯利康的替格瑞洛片上市后在全球及中国市场销售前景良好,2017年全球销售额已突破10亿美元,在中国公立医疗机构终端的销售额为5.03亿元,目前倍林达已经通过谈判的方式进入医保,医保支付标准从原来的10.94元/片下降到8.45元/片,放量可期。
目前国内市场除了原研厂家阿斯利康的产品上市销售,深圳信立泰的产品(90mg、60mg)挑战专利成功,分别于2018年7月及11月获得国家药监局批准,成为首个获批上市的仿制药。此外,还有包括扬子江药业、科伦药业、复星医药、正大制药、齐鲁制药等在内的35家企业(按集团计)按照仿制药4类、6类提交上市申请,竞争非常激烈。
借力优先审评,15个品种有望加速上市
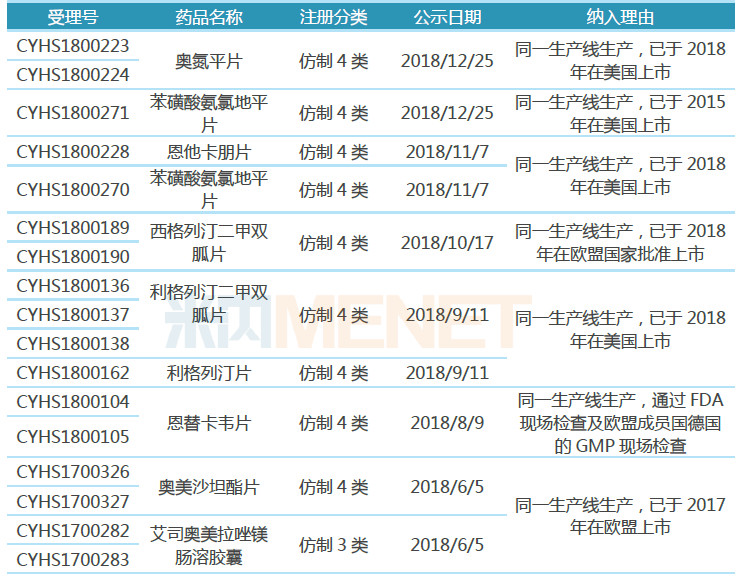
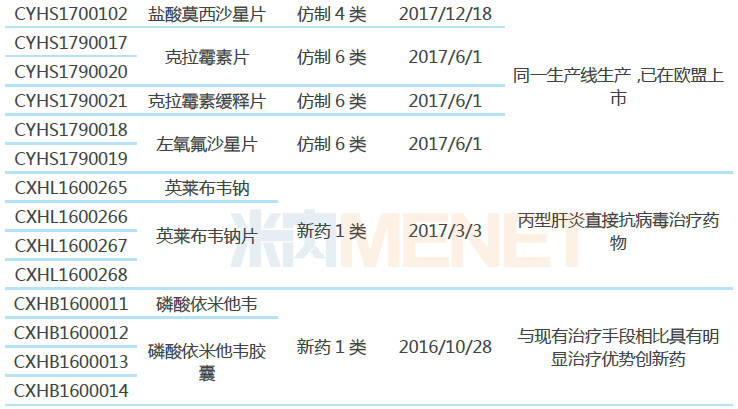
表1:东阳光药业纳入优先审评产品
 (来源:CDE官网、米内网数据库)
(来源:CDE官网、米内网数据库)
据CDE官网及米内网数据库,目前东阳光药业共有31个受理号(涉及15个品种)纳入优先审评,其中有23个受理号(涉及13个品种)以“同一生产线生产,已在美国或欧盟上市”为由纳入优先审评。
13个品种中有10个品种按照新注册分类(仿制3类、4类)提交上市申请,获批生产后视同通过一致性评价,其中盐酸莫西沙星片已获批生产,视同通过一致性评价;有3个品种虽按仿制6类申报上市,但因为是共线生产,因此也视同通过一致性评价。
从一致性评价竞争情况看,东阳光药业有多个品种竞争格局良好。奥氮平片目前仅5家企业拥有生产批文,江苏豪森药业的产品已通过一致性评价;恩他卡朋片、西格列汀二甲双胍片、利格列汀二甲双胍片、利格列汀片等品种目前仅原研厂家的产品有上市销售,暂未有其他仿制药获批生产;艾司奥美拉唑镁肠溶胶囊是唯一一个按仿制3类申报上市的品种,目前原研厂家的产品还未进入国内市场,也没有其他仿制药企业的产品获批生产。
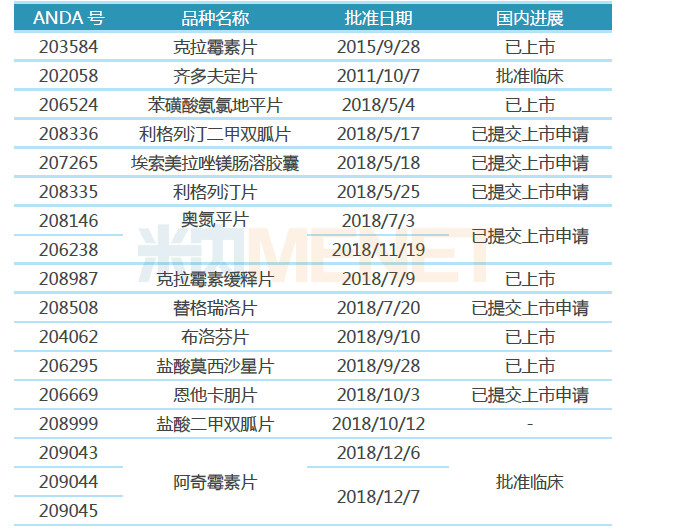
表2:2018年东阳光药业斩获的ANDA
(来源:上市公司公告、米内网数据库)
东阳光药业纳入优先审评的品种中,有13个仿制药已在海外获批上市,可见“国外转报国内”已成为公司布局国内一致性评价不可或缺的助力。据米内网统计,2018年东阳光药业在美国斩获14个ANDA,其中有5个品种已在国内获批上市,有6个品种已提交了上市申请。
4个品种已“通关”,一致性评价将迎爆发期
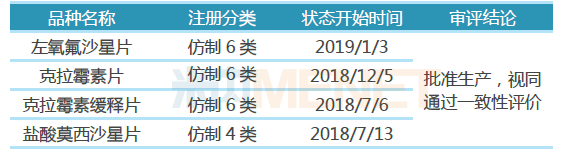
表3:东阳光药业通过或视同通过一致性评价
(来源:米内网数据库)
截至目前,东阳光药业已有4个品种首家视同通过一致性评价,分别为左氧氟沙星片、克拉霉素片、克拉霉素缓释片、盐酸莫西沙星片,这4个品种均为抗感染药物,其中左氧氟沙星片、克拉霉素片、盐酸莫西沙星片为“289品种”。
图2:左氧氟沙星片一致性评价信息

(点击图片可放大)
(来源:米内网一键检索)
2017年中国公立医疗机构终端左氧氟沙星片剂销售额为10.71亿元,目前在国内市场上市销售的包括左氧氟沙星片、盐酸左氧氟沙星片、乳酸左氧氟沙星片、甲磺酸左氧氟沙星片等,其中拥有左氧氟沙星片生产批文的厂家只有2家,目前仅东阳光药业的产品视同通过一致性评价。
图3:克拉霉素片一致性评价信息

(点击图片可放大)
(来源:米内网一键检索)
据米内网数据,目前拥有克拉霉素片生产批文的厂家多达36家,在一致性评价方面竞争也较为激烈,除了东阳光药业的产品视同通过一致性评价,上海现代制药、浙江贝得药业正针对该品种提交一致性评价补充申请。
图4:克拉霉素缓释片一致性评价信息

(点击图片可放大)
(来源:米内网一键检索)
缓释制剂等特殊制剂在制备上具备一定难度,拥有克拉霉素缓释片生产批文的企业数未超过10家,目前仅东阳光药业的产品视同通过一致性评价,暂未有其他企业提交一致性评价补充申请。
图5:盐酸莫西沙星片一致性评价信息

(点击图片可放大)
(来源:米内网一键检索)
除原研厂家外,目前拥有盐酸莫西沙星片生产批文的国内仿制药企业仅有3家,东阳光药业与四川国为制药的产品视同通过一致性评价,暂未有其他企业提交一致性评价补充申请。
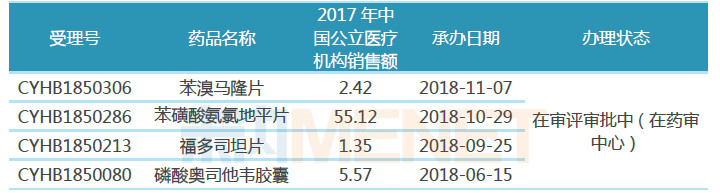
表4:东阳光药业一致性评价申请情况(单位:亿元)
(来源:米内网数据库)
截至目前,东阳光药业共有4个品种提交一致性评价补充申请,均处于“在审评审批中(在药审中心)”状态,苯溴马隆片、福多司坦片、磷酸奥司他韦胶囊目前均没有企业通过或视同通过一致性评价。
东阳光药业重磅品种磷酸奥司他韦胶囊的一致性评价补充申请于2018年6月15日获得CDE承办受理,目前未有其他企业提交该品种一致性评价补充申请,公司有望成为该品种首个通过一致性评价的企业。
从一致性评价补充申请看,虽然东阳光药业提交的品种数不多,但其通过海内外共线生产,“国外转报国内”的方式,已按照仿制3类、4类提交了17个仿制药的上市申请,2019年公司一致性评价品种将迎来爆发期。
来源:米内网数据库、CDE官网
注:数据统计截至2月13日,如有疏漏,欢迎指正!