摘要
仿制注册申请回升,一致性评价申请同比基本持平 有6家企业提交阿莫西林胶囊一致性评价申请 人福药业提交麻醉新药磷丙泊酚二钠上市申请 TAF(富马酸替诺福韦艾拉酚胺)首仿申请进入CDE 多个印度企业提交5.2类仿制药进口申请 华海药业盐酸多奈哌齐片获批上市,视同通过一致性评价
总体承办情况:仿制申请回升,一致性评价申请持平
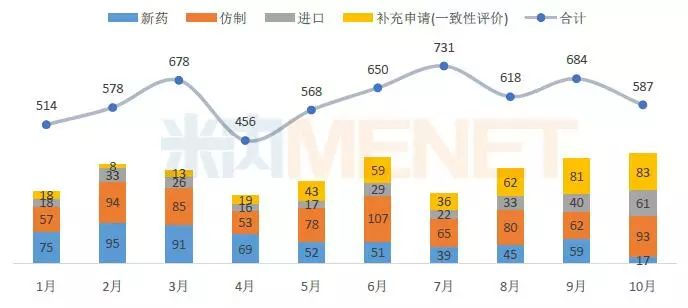
据MED中国药品审评数据库2.0统计,2018年10月CDE共承办药品注册申请587个,总体有所下滑,从申请类型看,新增新药申请为17个,同比出现明显下滑,仿制申请和进口申请同比均有所上升,补充申请(一致性评价)有83个,同比基本持平。
图1:2018年1-10月CDE承办药品注册申请情况(按受理号计)
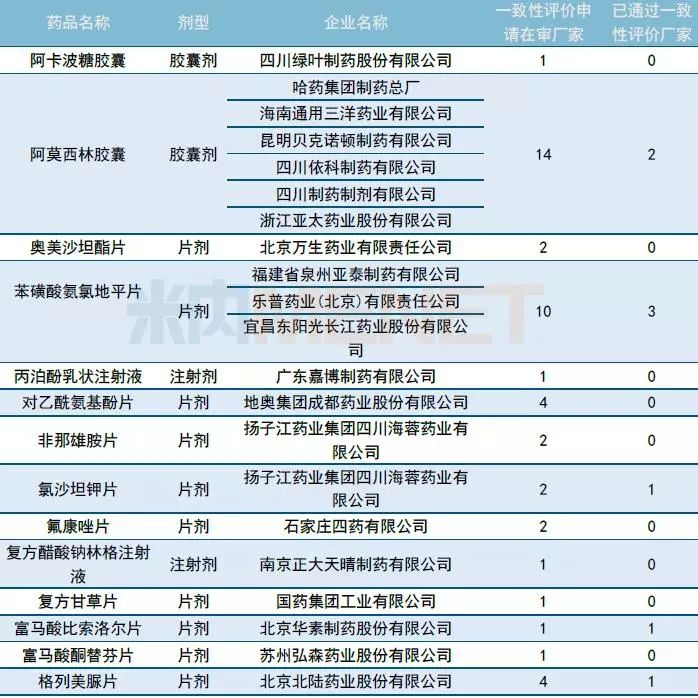
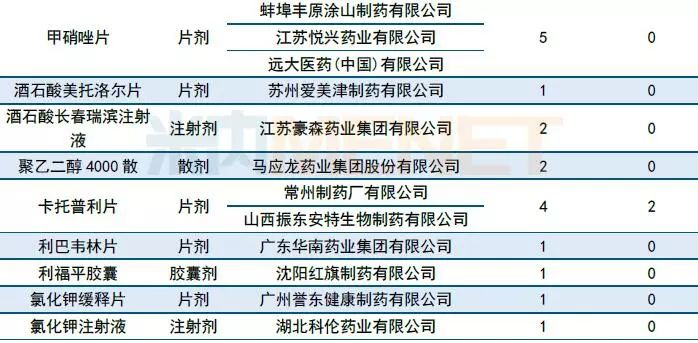
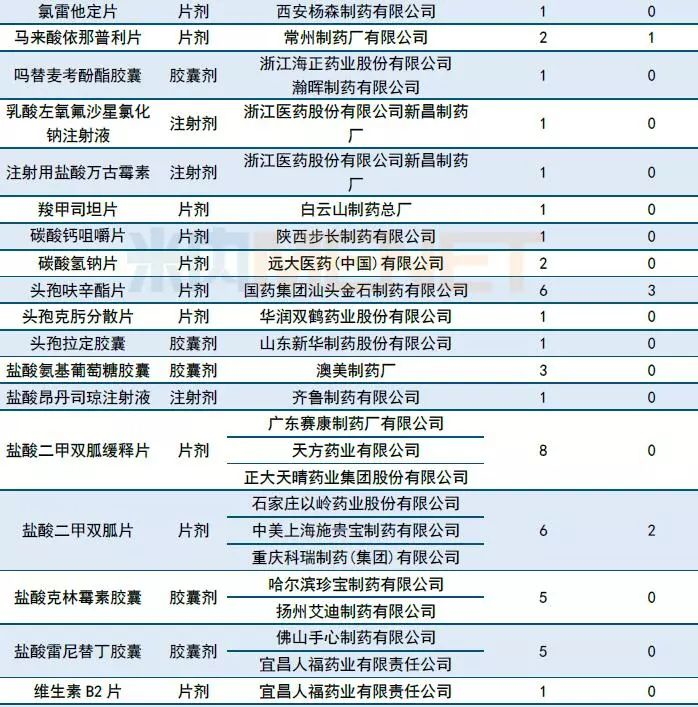
一致性评价承办情况: 6家企业申报阿莫西林胶囊一致性评价
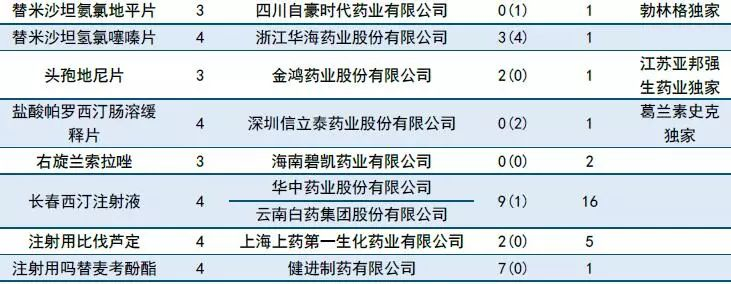
10月有51个一致性评价品种获CDE承办,同比继续增加(9月有47个品种),其中注射剂有11个。
10月再有6家企业的阿莫西林胶囊一致性评价申请进入CDE。据MED中国药品审评数据库2.0统计,截至10月31日,申报阿莫西林一致性评价的企业已达17家,其中胶囊剂有16家,颗粒剂有1家,通过一致性评价目前有2家(珠海联邦制药股份有限公司中山分公司以及浙江金华康恩贝生物制药有限公司的胶囊剂)。
表1:2018年10月CDE补充申请(一致性评价)品种承办情况
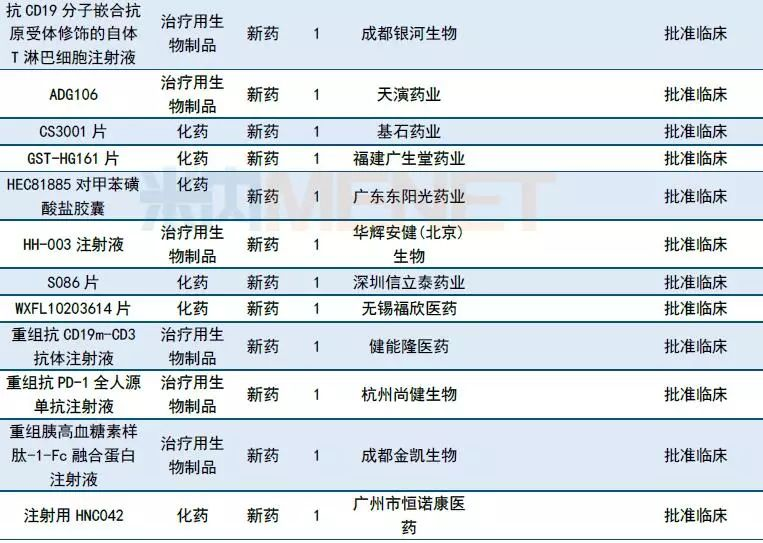
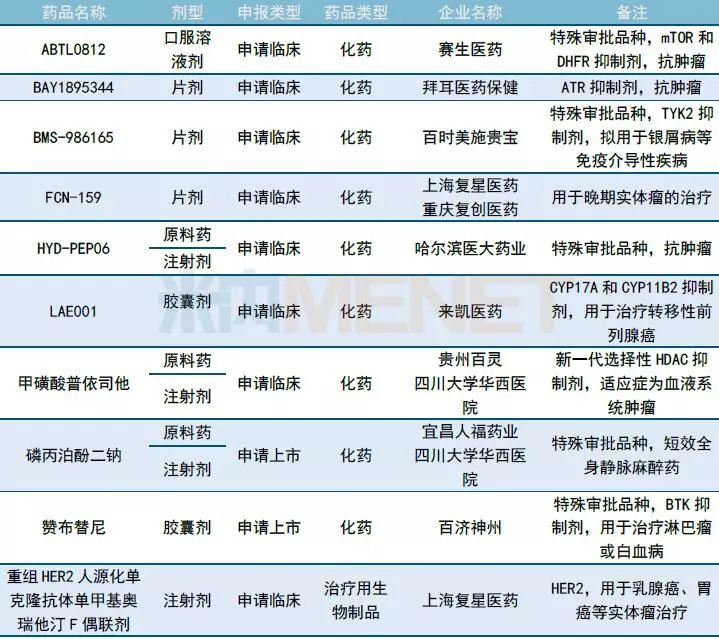
国内1类新药承办情况:人福药业提交麻醉新药磷丙泊酚二钠上市申请
10月共有10个1类新药进入CDE。宜昌人福药业有限责任公司和四川大学华西医院联合提交麻醉新药注射用磷丙泊酚二钠上市申请。据了解,磷丙泊酚二钠是一种水溶性的丙泊酚前药,也是目前国外研究最先进的短效全身静脉麻醉药。其他情况请见下表。
表2:2018年10月国内1类新药承办情况
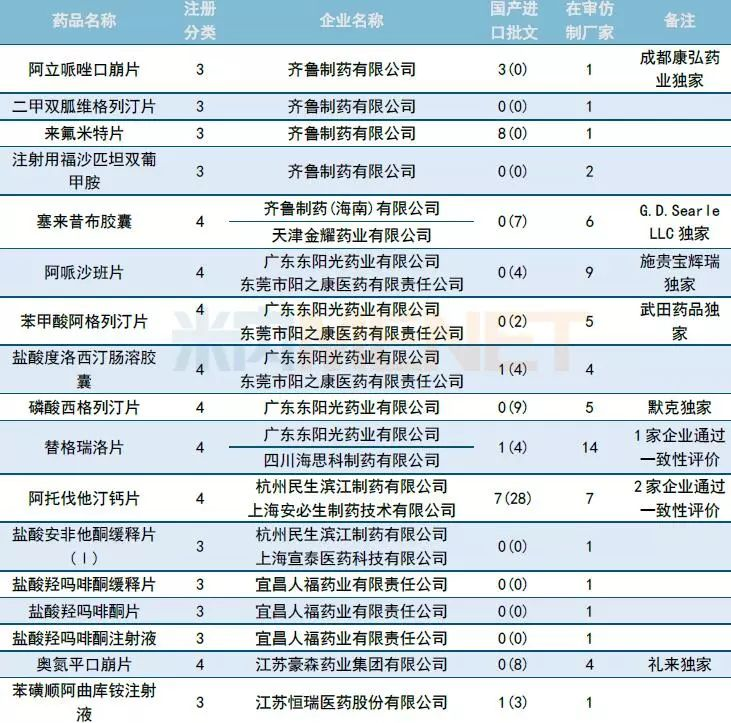
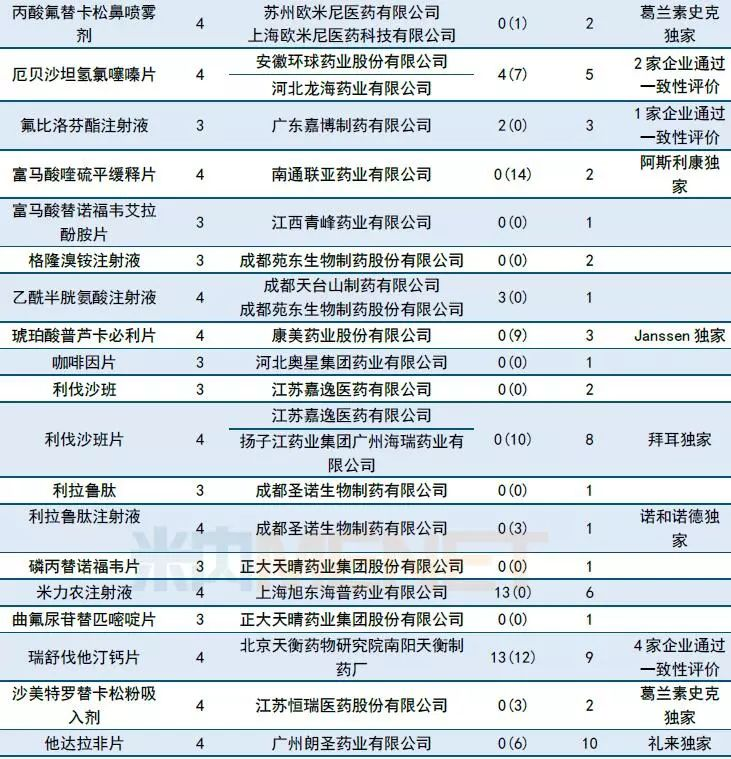
国内仿制申请承办:富马酸替诺福韦艾拉酚胺首仿申请进入CDE
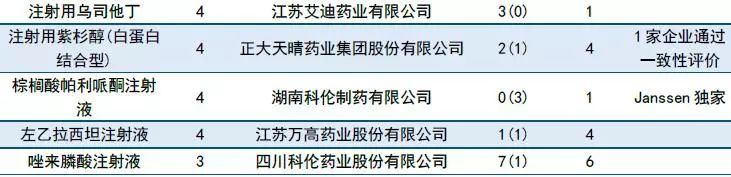
10月CDE共长湴47个品种的仿制申请,其中有27个品种目前为国内独家品种,6个品种目前已有企业通过一致性评价。
正大天晴和江西青峰药业在10月先后提交TAF(磷丙替诺福韦片,又称富马酸替诺福韦艾拉酚胺片)的仿制申请。目前福建广生堂药业(临床试验登记号:CTR20181674)、齐鲁制药 (CTR20181971)以及四川科伦药业(CTR20182012)也在布局TAF,生物等效性试验(BE)尚在进行中。
广东东阳光药业以及齐鲁制药在10月份各有5个仿制药进入CDE。长春西汀注射液(16家)、替格瑞洛片(14家)、他达拉非片(10家)等品种仿制申请在审厂家超过10家,竞争十分激烈。
表3:2018年10月仿制药承办情况
 进口申请承办情况:多个印度仿制药申请进口
进口申请承办情况:多个印度仿制药申请进口
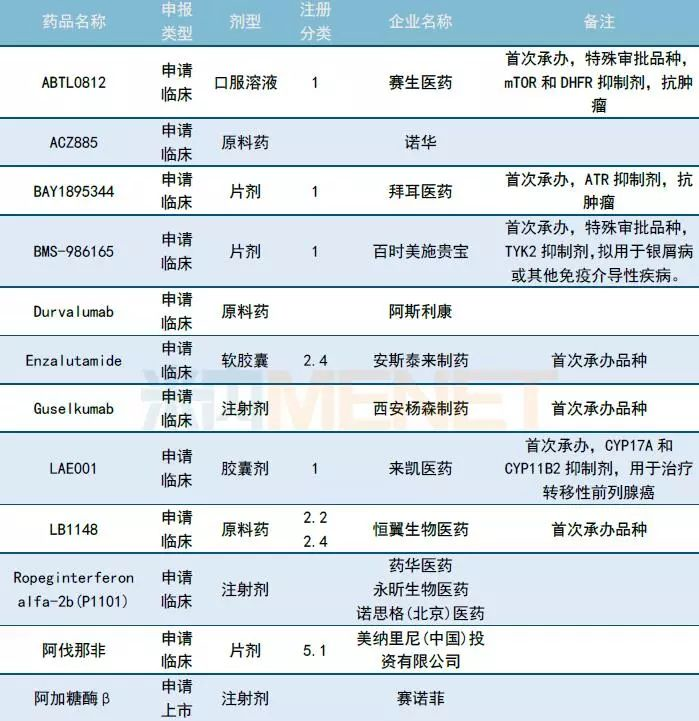
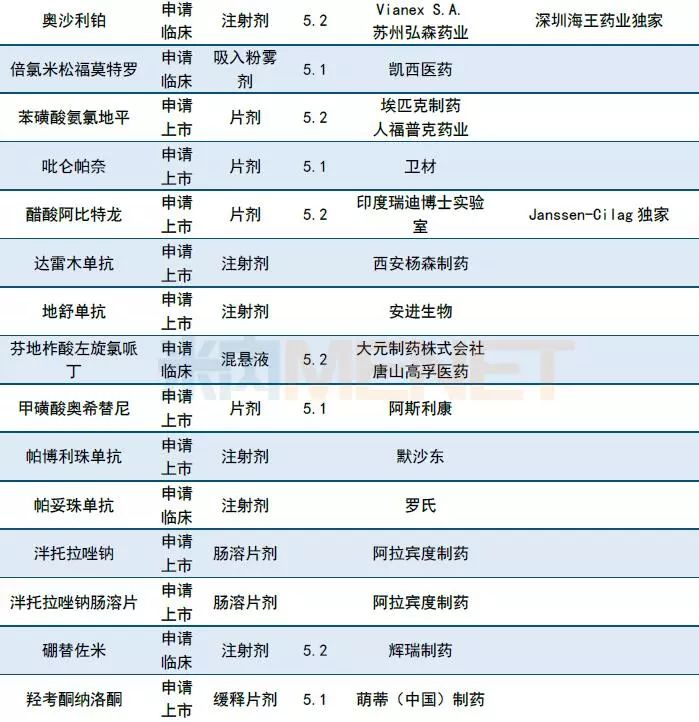
10月CDE共承办35个品种的进口申请,ABTL0812、BAY1895344、BMS-986165、Enzalutamide、Guselkumab、LAE001、LB1148等品种为CDE首次承办品种。印度瑞迪博士实验室、阿拉宾度制药、印度太阳药业等印度企业均有仿制品种提交进口申请,详细情况请见下表。
表4:2018年10月CDE进口品种承办情况

获批情况:华海药业盐酸多奈哌齐片获批
据米内网MED中国药品审评数据库2.0显示,10月有多个品种通过仿制药一致性评价。华海药业4类仿制药盐酸多奈哌齐片获批生产,视同通过一致性评价。
表5:2018年10月部分品种获批情况