
精彩内容
4个国产1类新药获批上市;
甘李药业入局超50亿大品种;
首款儿童红斑狼疮创新疗法获批;
全球首款皮下注射PD-L1报产;
3款中成药1类新药申报上市;
43个国产1类新药获批临床;
正大天晴、科伦新药申报临床。
28个新药上市申请新进展,4款国产1类新药获批
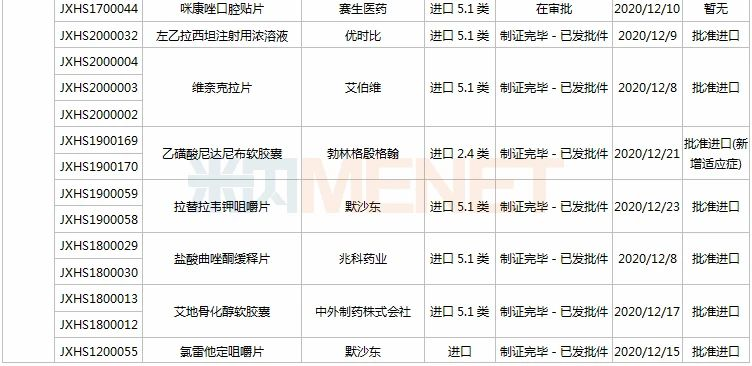
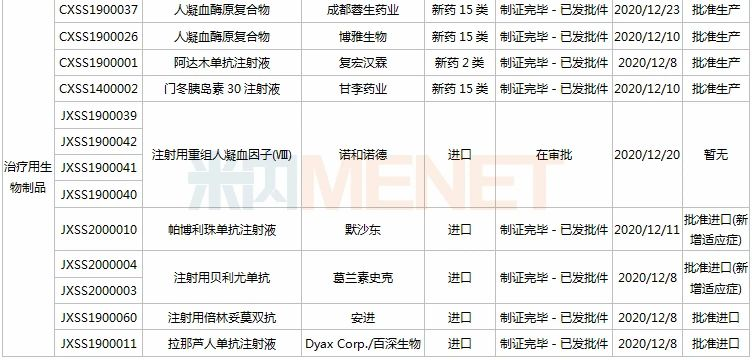
11月28日-12月25日期间,28个新药(45个受理号)的上市申请有审评审批状态更新。8款国产新药获批上市,其中东阳光药的磷酸依米他韦胶囊、海思科的HSK3486乳状注射液、恒瑞的氟唑帕利胶囊、诺诚健华的奥布替尼片为1类新药;11个新药批准进口,其中勃林格殷格翰的乙磺酸尼达尼布软胶囊、默沙东的帕博利珠单抗注射液、葛兰素史克的注射用贝利尤单抗为新适应症获批;和黄医药的索凡替尼胶囊、正大天晴的盐酸安罗替尼胶囊等9个药品的上市申请注册办理状态变更为“在审批”。
(11.28-12.25)新药上市申请审评审批状态更新
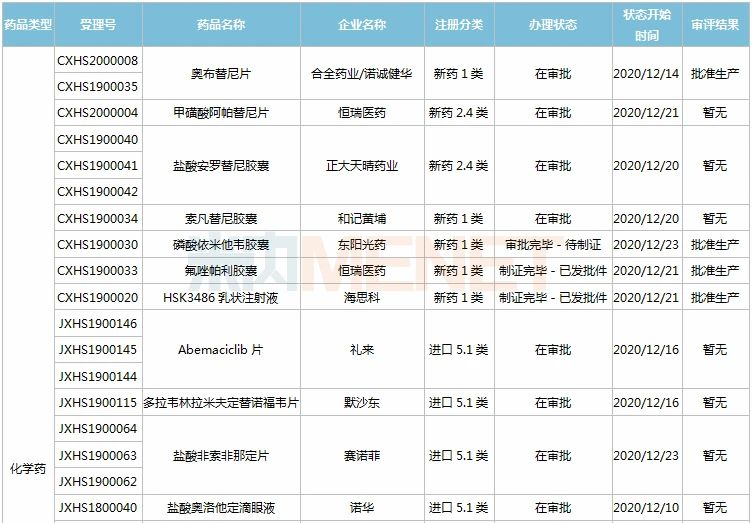
4款国产1类新药获批上市。东阳光药的磷酸依米他韦胶囊是一款丙肝病毒非结构蛋白5A(NS5A)蛋白抑制剂,联合索磷布韦片治疗丙肝,这是该公司首款获批的1类新药;恒瑞的氟唑帕利胶囊属于PARP抑制剂,可特异性杀伤BRCA突变的肿瘤细胞,这是该公司获批的第7款1类新药;海思科的环泊酚注射液(HSK3486乳状注射液)为短效GABAA受体调节剂,是该公司历时八年研发的一款具有自主知识产权的静脉麻醉药物,也是该公司首个获批的1类新药;奥布替尼片是诺诚建华自主研发的新型、强效BTK抑制剂,临床研究显示其具有更高的BTK选择性和将近100%的BTK占有率,全球首款BTK抑制剂伊布替尼2019年全球销售额超过80亿美元。
1款国产1类新药即将上市。索凡替尼胶囊是和黄医药自主研发的一种新型的口服酪氨酸激酶抑制剂,有望成为该公司第2款获批上市的1类新药。
近几年来中国公立医疗机构终端胰岛素及其类似药产品格局中,门冬胰岛素30注射液一直占据榜首位置,2019年销售额超过50亿元,2020H1增速达10%以上,市场潜力较大,甘李药业的产品获批上市,打破了诺和诺德独家垄断的局面。
复宏汉霖的阿达木单抗注射液是国内第4款获批上市的阿达木单抗生物类似药,也是该公司第3款在国内获批上市的单抗生物药。阿达木单抗是一款全人源抗肿瘤坏死因子α(TNF-α)抗体,原研产品2019年全球销售额近200亿美元。
葛兰素史克的注射用贝利尤单抗为人源化的单克隆抗体,是全球首个获批用于系统性红斑狼疮的生物制剂,能够特异性地与B淋巴细胞刺激因子(BLyS)结合,抑制B细胞的生存。该产品最早于2019年7月获批进入国内市场,此次为新适应症获批上市,成为国内首款治疗儿童红斑狼疮的创新疗法。
注射用倍林妥莫双抗是安进公司研发的一款同时靶向CD19和CD3的双特异性抗体,是FDA批准的首款双特异性T细胞接合器(BiTE)免疫疗法。此次是该产品在国内首个获批的适应症,这意味着中国迎来首款治疗急性淋巴细胞白血病(ALL)的双特异性抗体药物。
维奈克拉片是艾伯维与罗氏共同开发的全球首款BCL-2抑制剂,自问世以来曾多次被FDA授予突破性疗法认定。维奈克拉片也是国内首个获批上市的BCL-2抑制剂,联合其它药物用于治疗年龄75岁及以上,或因合并症不适于接受强诱导化疗的新诊断的成人急性髓性白血病。
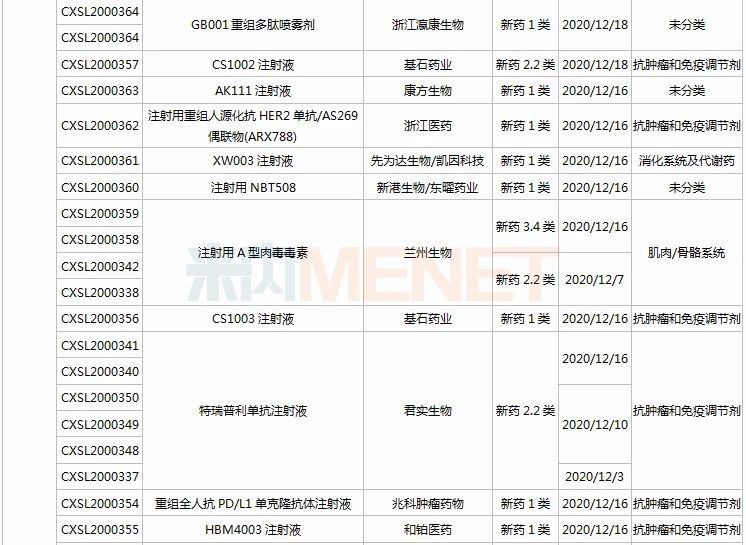
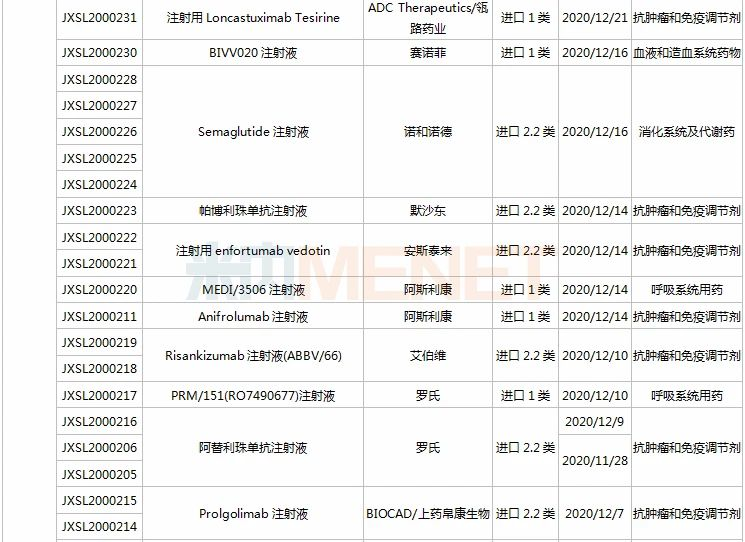
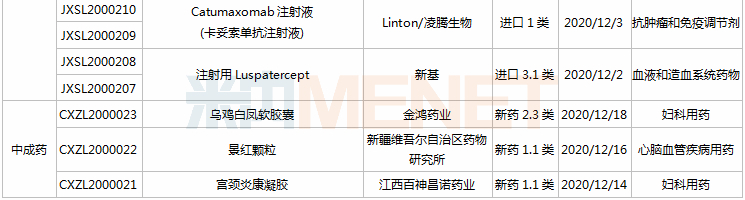
21个新药申请上市,全球首款皮下注射PD-L1来了
11月28日-12月25日期间,21个新药(33个受理号)上市申请获得CDE承办,集中抗肿瘤和免疫调节剂领域(13个品种);7个品种(7个受理号)为国产新药,14个品种(26个受理号)为进口新药。从药品类型看,9个品种(13个受理号)为化学药,9个品种(17个受理号)为治疗用生物制品,3个品种(3个受理号)为中成药。
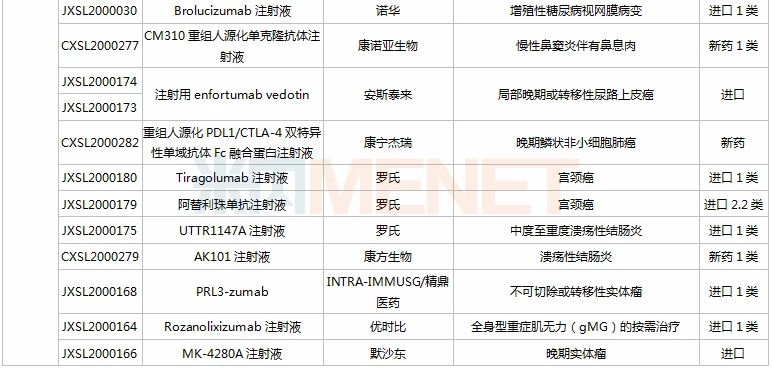
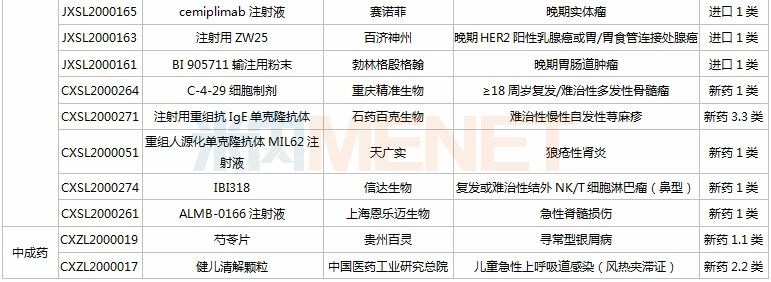
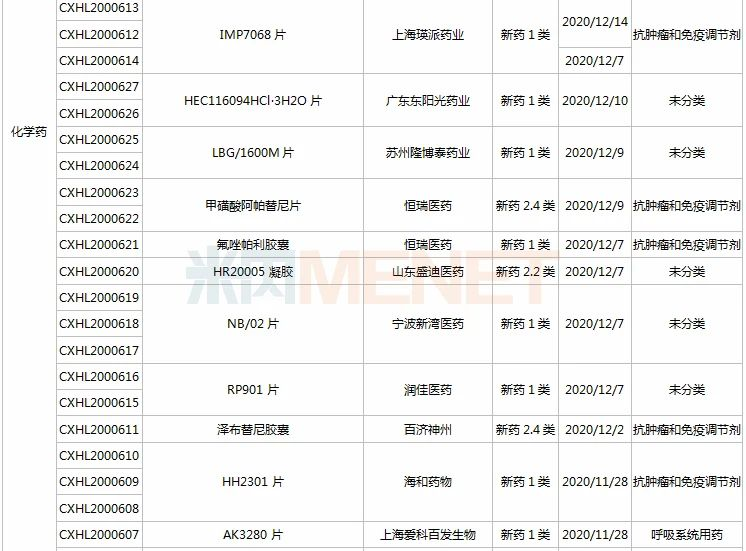
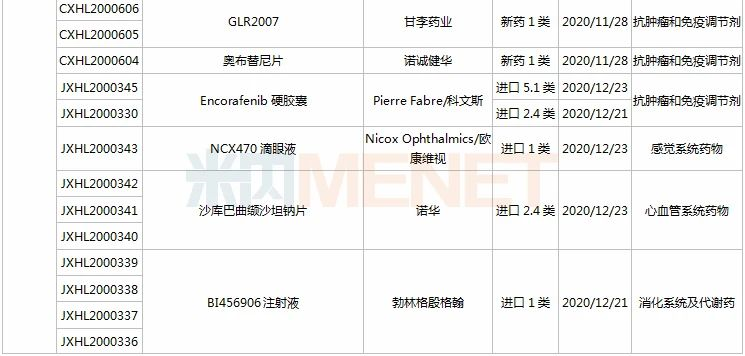
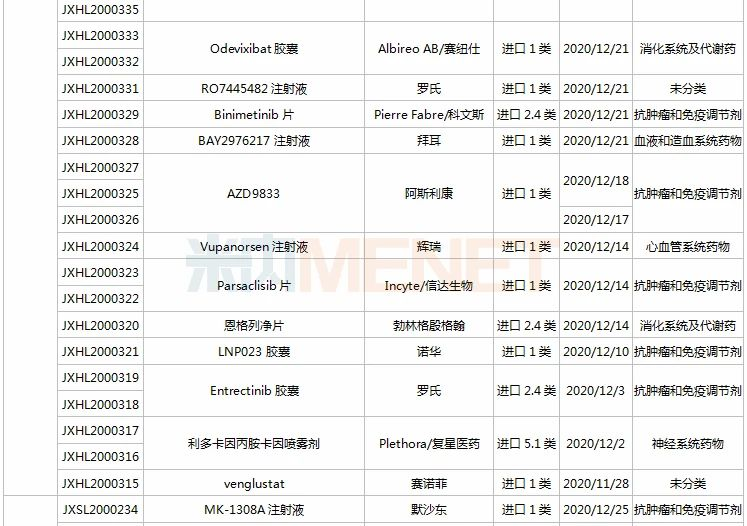
(11.28-12.25)承办的国产/进口新药上市申请
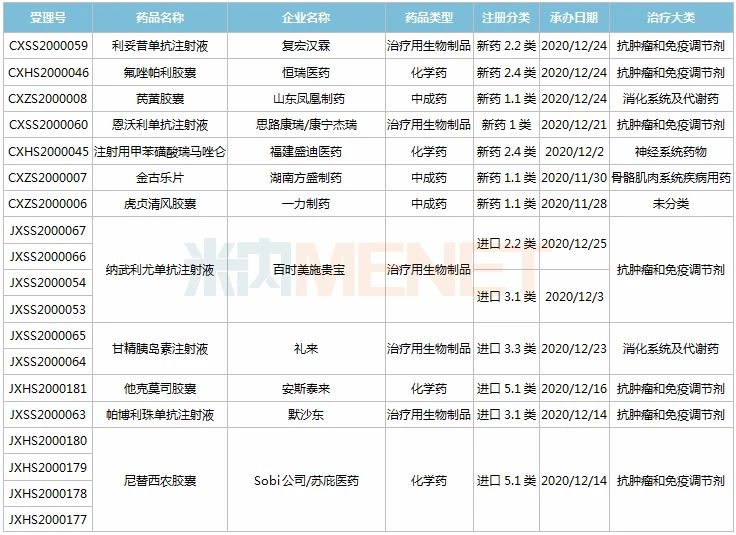
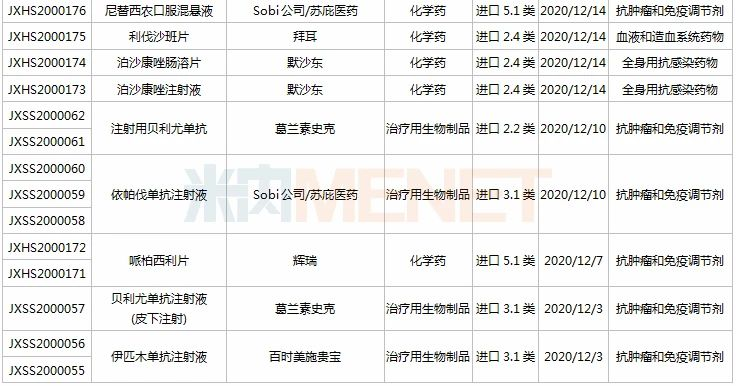
3款中成药1类新药申报上市,为山东凤凰制药的芪黄胶囊、方盛制药的金古乐片及一力制药的虎贞清风胶囊。金古乐片具有活血舒筋、通脉止痛、补肾健骨的功效,对膝骨关节炎(筋脉瘀滞证)所致局部疼痛、关节僵硬、日常活动不利受限、局部肿胀、压痛等症状具有良好的改善作用,且服用安全。
恒瑞2款新药申报新适应症,PARP抑制剂氟唑帕利胶囊首个适应症于今年12月获批上市,第2个适应症随后报产,用于复发性卵巢癌维持治疗;注射用甲苯磺酸瑞马唑仑为短效GABAa受体激动剂,胃镜诊疗镇静、结肠镜诊疗镇静两大适应症已获批上市。
恩沃利单抗注射液(KN035)是康宁杰瑞自主研发的重组人源化PD-L1单域抗体Fc融合蛋白注射液,由思路迪负责其肿瘤适应症的临床开发,先声药业负责中国大陆的商业化推广。基于独特设计,KN035在安全性、方便性、依从性等方面具有优势,有望成为全球第一款皮下注射PD-L1抑制剂。
帕伐单抗注射液(emapalumab)是一款与干扰素γ(IFNγ)结合的单克隆抗体,是FDA批准的首款针对HLH的抗体疗法,曾获FDA授予的突破性疗法认定、优先审评资格和孤儿药资格,此次首次在国内提交上市申请。
98个新药获批临床,东阳光药、片仔癀、海思科......
11月28日-12月25日期间,98个新药(140个受理号)获得临床试验默示许可,其中56个品种(83个受理号)为国产新药(43个为1类新药),42个品种(57个受理号)为进口新药;从药品类型看,化学药有55个、治疗用生物制品有41个、中成药有2个。
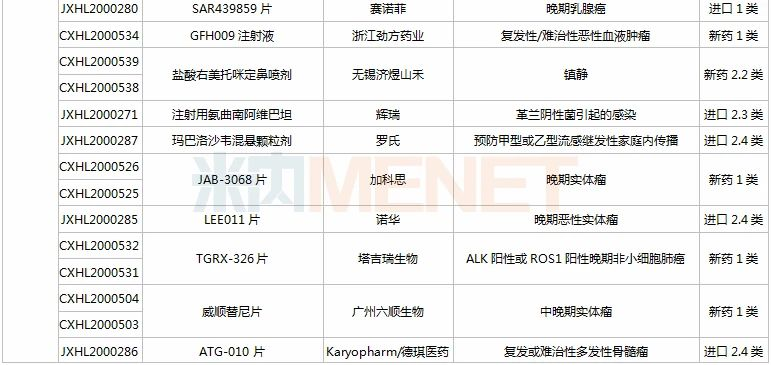
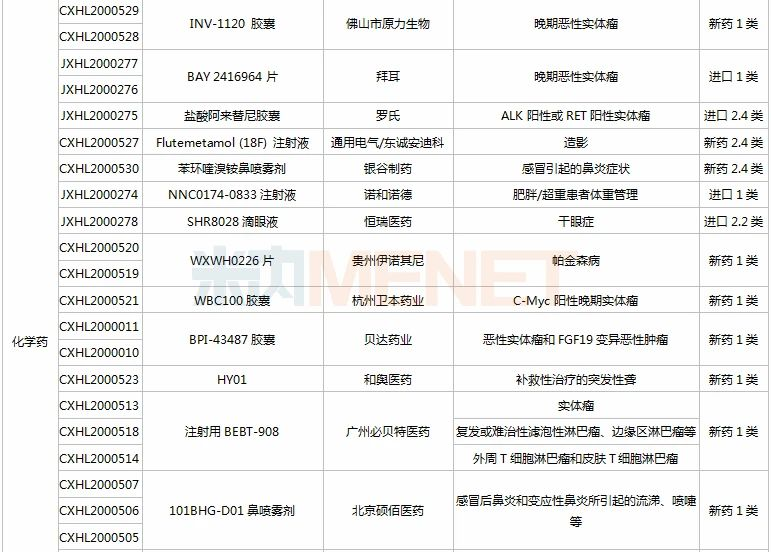
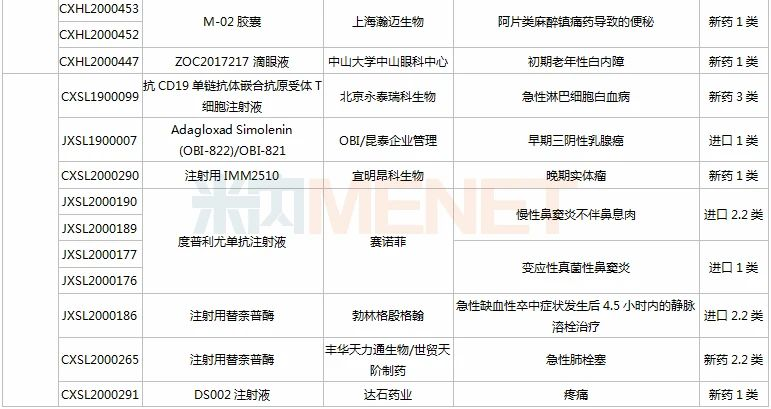
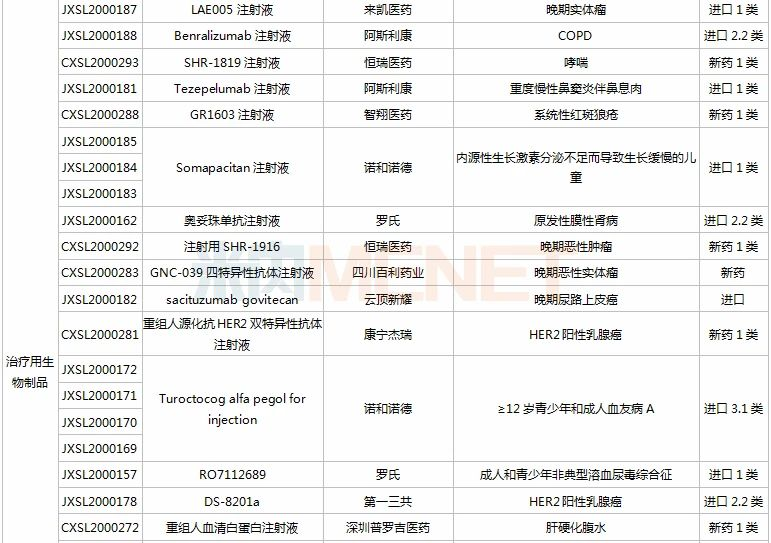
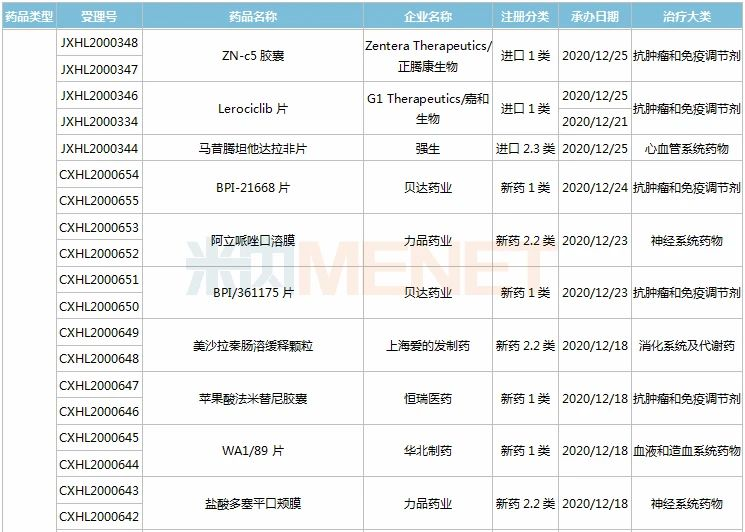
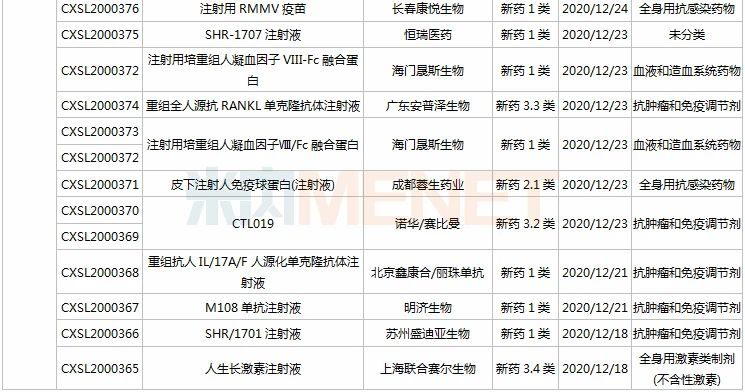
(11.28-12.25)获批临床的国产/进口新药
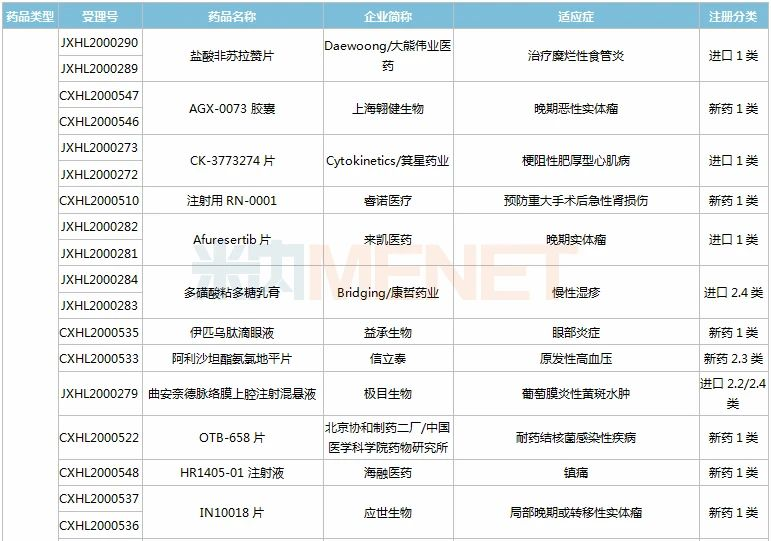
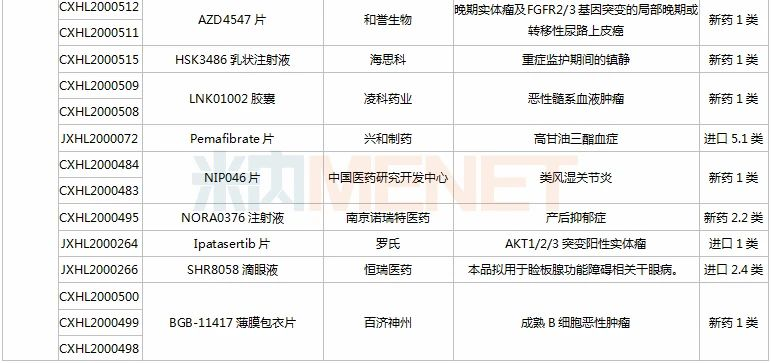
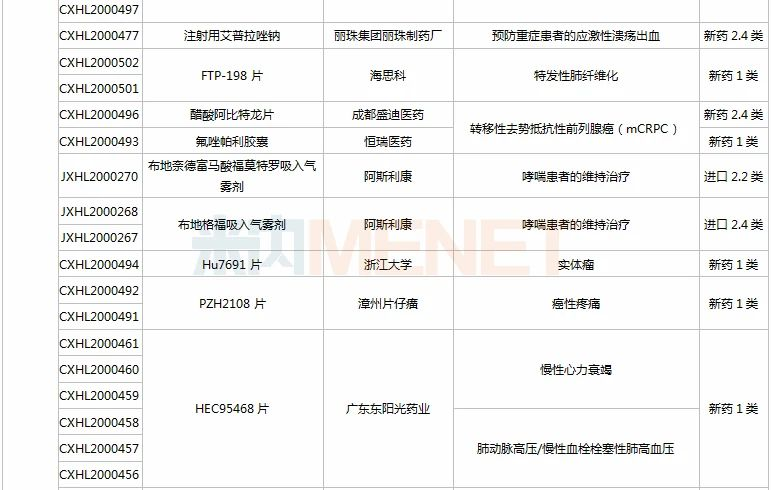
恒瑞医药有6款新药获批临床。SHR8028滴眼液、SHR8058滴眼液均为引进的滴眼液,SHR-1819注射液(哮喘)、注射用SHR-1916(晚期恶性肿瘤)首次在国内获批临床。
百济神州有2款1类新药获批临床,其中BGB-11417薄膜包衣片是一款高选择性、潜在“best-in-class”的Bcl-2抑制剂,具备有望克服耐药性,如有需要可提高剂量用于实体瘤适应症等潜在优势。目前该产品已在澳大利亚开展1a/1b期临床,此次为首次在国内获批临床。
诺和诺德有3款新药获批临床,其中Somapacitan注射液是一种新颖、可逆的、与白蛋白结合的人生长激素衍生物,于今年8月底获得FDA批准上市,是全球首款每周仅需皮下注射一次的长效人类生长激素(hGH)疗法,此次在国内首次获批临床。
阿斯利康有4款新药获批临床,其中Benralizumab注射液是一款IL-5Rα抑制剂,拟开发适应症为慢性阻塞性肺疾病;Tezepelumab注射液是一款潜在“first-in-class”的TSLP抑制剂,拟开发适应症为重度慢性鼻窦炎伴鼻息肉。
拜耳的BAY 2416964片是一款强效、选择性和交叉反应性的芳香烃受体(AhR)抑制剂,能够发挥多种抗肿瘤免疫调节作用,目前在全球尚处于早期开发阶段,此次为该产品首次在中国获批临床。
塔吉瑞生物的TGRX-326片是靶向作用于EML4-ALK融合基因的ALK第三代高效抑制剂,能有效克服现有耐药问题,具备成为“best-in-class”的潜力,此次为该产品首次在中国获批临床。
注射用enfortumab vedotin是安斯泰来研发的一款靶向Nectin-4的“first-in-class”抗体偶联药物(ADC),曾获得FDA授予的突破性疗法认定和优先审评资格,已于2019年底在美国获批上市,用于治疗局部晚期或转移性尿路上皮癌,此次在国内首次获批临床。
上海恩乐迈生物(石药子公司)的ALMB-0166注射液是一款靶向半通道膜蛋白Connexin43的“first-in-class”人源化单克隆抗体抑制剂,该产品已获得FDA授予的孤儿药资格认定(骨癌),并已获批在澳大利亚开展临床试验(骨癌和癌症骨转移)。
重组人源化单克隆抗体MIL62注射液是天广实自主研发的一种创新型的II型抗CD20重组人源化单克隆抗体,拟开发用于狼疮性肾炎。此前,该产品已有多项适应症在国内获批临床,复发/难治的滤泡性淋巴瘤和边缘区淋巴瘤适应症已在开展II期临床。
IBI318是信达和礼来共同研发的一款重组全人源IgG1抗PD-1/PD-L1双特异性抗体,此次获批临床的为新适应症,用于复发或难治性结外NK/T细胞淋巴瘤。双特异性抗体已成为信达重点研发领域之一,IBI323(新型LAG-3/PD-L1双抗)、IBI322(CD47/PD-L1双抗)、IBI315(PD-1/HER2双抗)、IBI319等均已获批临床。
94个新药临床申请获承办,正大天晴、科伦......
11月28日-12月25日期间,94个新药(158个受理号)的临床申请获CDE承办受理,其中59个品种(96个受理号)为国产新药(42个为1类新药),35个品种(62个受理号)为进口新药。从药物类型看,化学药、治疗用生物制品、中成药分别有46个、45个、3个。
(11.28-12.25)承办的国产/进口新药临床申请
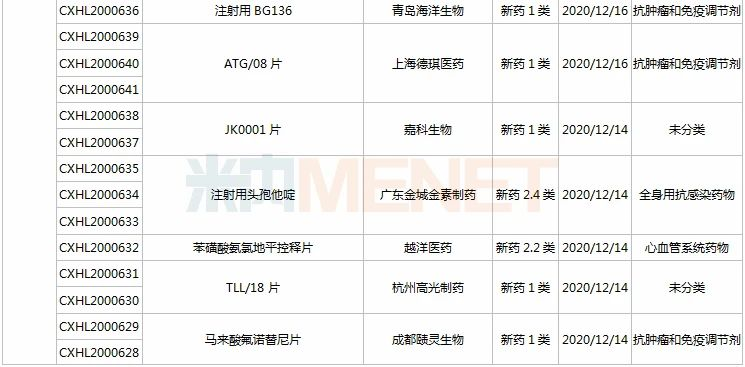

HEC116094HCl·3H2O片为东阳光药研发的1类新药,米内网数据显示,目前东阳光药已有28个1类新药申报临床,其中有7个于2020年提交临床申请,HEC89736PTSA·0.5H2O片、HEC122505MsOH片、HEC95468片、HEC73077片以及HEC116094HCl·3H2O片为首次申报临床,前3款已获批临床。
司库奇尤单抗是诺华研发的一款靶向IL-17A的生物制剂,2019年全球销售额超过35亿美元,目前已在国内获批用于中重度斑块型银屑病和强直性脊柱炎。百奥泰生物首家在国内提交司库奇尤单抗生物类似药临床申请。
IMP7068片是英派药业基于其DNA损伤修复通路自主研发平台开发的一款全新化合物,属于Wee1(DNA损伤修复通路相关的重要激酶)抑制剂。前不久(2020年11月),该产品刚在美国获批临床。
甘李药业首次申报临床的GLR2007是一款在研CDK4/6抑制剂,用于治疗包括胶质母细胞瘤在内的恶性胶质瘤。该产品曾获得FDA授予的孤儿药资格,目前正在美国开展I期临床。
数据来源:米内网数据库、CDE、公司公告
注:数据统计时间段为11月28日-12月25日,按药品名称统计(不含预防用生物制品、体外诊断试剂等,不含补充申请),如有疏漏,欢迎指正!