
精彩内容
信达生物拿下$65亿明星药;
东阳光药进攻68亿大品种;
恒瑞两款1类新药申报上市;
首款三代BCR-ABL抑制剂报产;
国内首款CD19单抗申请进口;
19个国产1类新药获批临床;
3款中成药1类新药首次报临床。
6个新药上市申请新进展,信达拿下$65亿明星药
9月26日-10月23日期间,6个新药(8个受理号)的上市申请有审评审批状态更新。1个国产新药获批生产,为信达生物的利妥昔单抗注射液;2个新药批准进口,来自辉瑞、默克;2个进口新药进入行政审批阶段,暂无审评结果,为卫材的甲磺酸仑伐替尼胶囊、Basilea/华润九新的注射用头孢比罗酯钠。
(9.26-10.23)新药上市申请审评审批状态更新
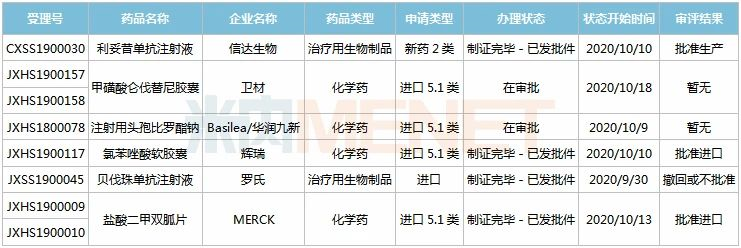
信达生物的利妥昔单抗注射液是美罗华(2019年全球销售额超过65亿美元)的生物类似药。米内网数据显示,2019年中国公立医疗机构终端利妥昔单抗注射液销售额超过40亿元,复宏汉霖拿下国内首个生物类似药,信达的产品为国产第2家。
辉瑞的氯苯唑酸软胶囊是一种致死性罕见病新药,用于治疗成人野生型或遗传型转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)。目前辉瑞开发的两款转甲状腺素蛋白稳定剂口服制剂--氯苯唑酸葡甲胺、氯苯唑酸均已获批进入国内市场。
注射用头孢比罗酯钠是华润三九引进的第五代头孢抗生素,对多种革兰氏阴性菌、革兰氏阳性菌均有抑制作用。相比于其他抗生素,头孢比罗酯钠具有更加广谱的抗菌活性,同时能够满足目前临床抗生素耐药菌的治疗需求。
17个新药申请上市,东阳光药进攻68亿大品种
9月26日-10月23日期间,17个新药(33个受理号)上市申请获得CDE承办,涵盖九个治疗大类,集中在消化系统及代谢药(4个)及抗肿瘤和免疫调节剂(3个)领域;8个品种(11个受理号)为国产新药,9个品种(22个受理号)为进口新药。从药品类型看,10个品种(17个受理号)为化学药,7个品种(16个受理号)为治疗用生物制品。
(9.26-10.23)获承办的国产/进口新药上市申请
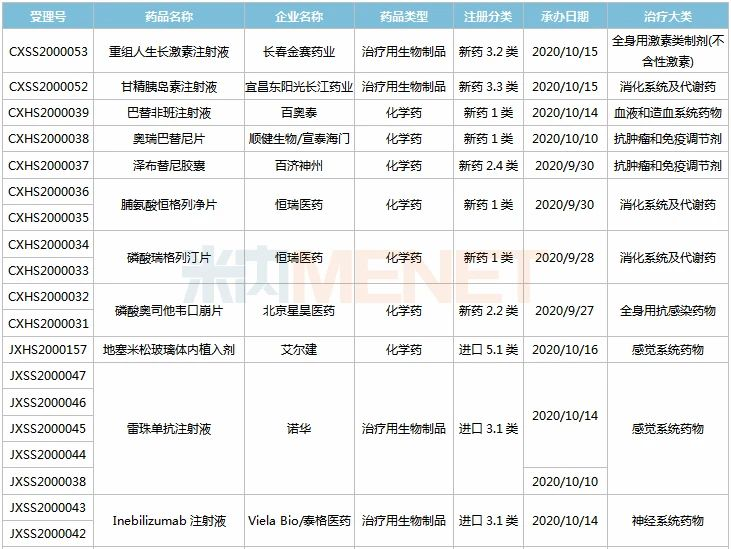
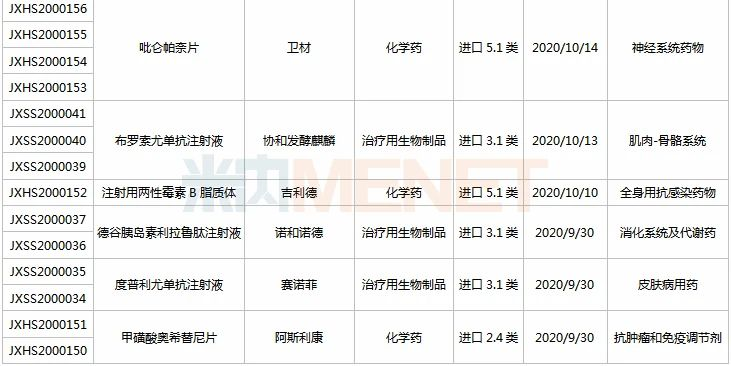
恒瑞医药两款糖尿病1类新药报产。脯氨酸恒格列净片为首个报产的国产SGLT-2抑制剂,同靶点在研新药有东阳光药的荣格列净、轩竹医药的加格列净等;磷酸瑞格列汀片属于DPP-4抑制剂,目前国内已有5款同靶点产品获批上市,均为外企研发,且均有仿制药获批。
东阳光药的甘精胰岛素注射液是一种新型的胰岛素类似物,具有长效、血药浓度无峰值、平稳地降低患者血糖的作用。该公司首款胰岛素类似物重组人胰岛素注射液于2020年6月获批上市。米内网数据显示,2019年中国公立医疗机构及城市零售药店终端胰岛素及其类似药市场规模超过280亿元,其中甘精胰岛素注射液的销售额超过68亿元。
百奥泰的巴替非班注射液是一种人工合成的血小板糖蛋白IIb/IIIa(GPIIb/IIIa)受体拮抗剂,用于PCI围术期抗血栓。目前国内同靶点已获批产品有替罗非班,该产品在2019年中国公立医疗机构终端终端的销售额接近5亿元。
顺健生物(亚盛医药子公司)与宣泰海门联合申报的奥瑞巴替尼片是国内首个第三代BCR-ABL靶向耐药CML治疗药物,对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有突出效果。2019年7月,该产品获得FDA许可直接进入Ib期临床,并于2020年5月接连获得FDA授予的孤儿药和审评快速通道资格。
VielaBio/泰格医药的Inebilizumab注射液是国内首款申报上市的CD19单抗,豪森于2019年5月以超过2.2亿美元的首付款+里程碑付款获得该药在中国的开发和商业化权益,这是豪森药业引进的首款生物药,目前已获得FDA批准上市。
赛诺菲的度普利尤单抗注射液是FDA批准上市的首个治疗特应性皮炎的生物制剂,于2020年6月首次在中国获批上市,此次为第2个适应症报产。财报显示,2020上半年度普利尤单抗全球销售额达16.34亿欧元,同比增长93.8%,赛诺菲计划将其打造为年销售额过100亿欧元的重磅炸弹。
41个新药获批临床,国产1类新药占近“半壁江山”
9月26日-10月23日期间,41个新药(62个受理号)获得临床试验默示许可,其中28个品种(47个受理号)为国产新药(19个为1类新药),13个品种(15个受理号)为进口新药;从药品类型看,化学药有21个、治疗用生物制品有20个。
(9.26-10.23)获批临床的国产/进口新药

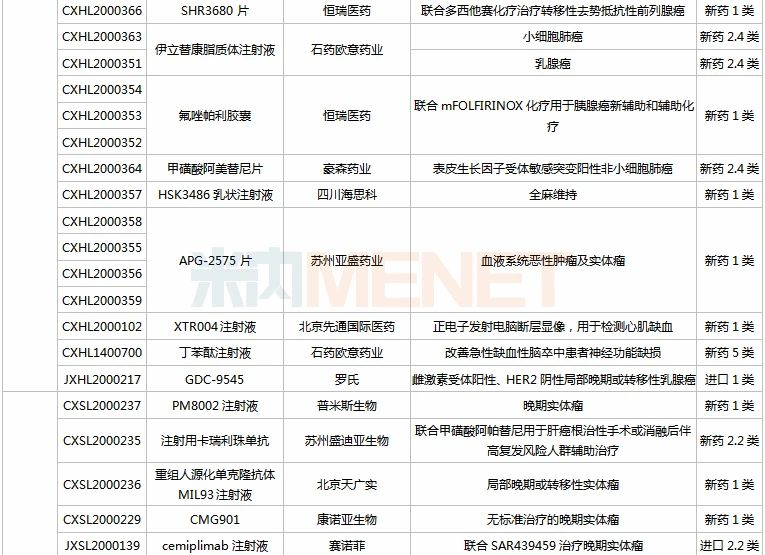
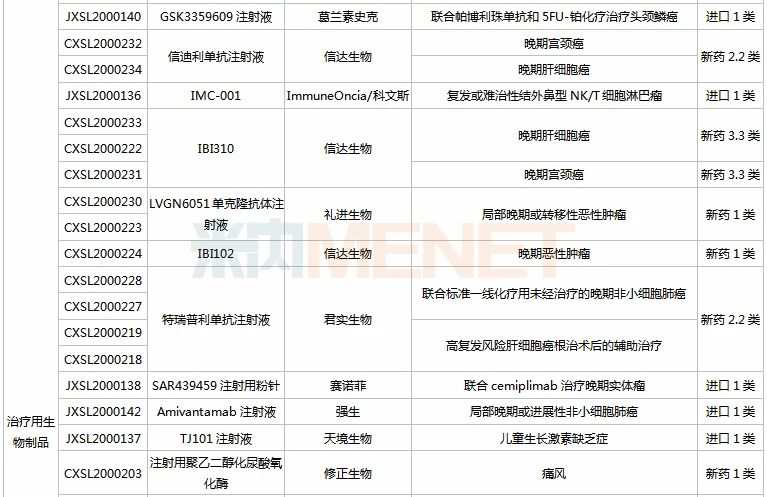
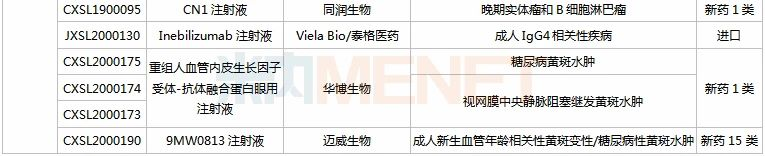
信达、恒瑞均有3款新药获批临床。其中信达的PD-1单抗信迪利单抗注射液目前有20多项临床研究正在进行,抗GITR单抗IBI102首次在华获批临床;恒瑞的甲磺酸阿帕替尼片(已有适应症获批上市)、SHR3680片(AR受体拮抗剂)、氟唑帕利胶囊(PARP抑制剂)均非首次获批临床。
海王生物的HW130注射用浓溶液是一种新型肿瘤血管阻断剂,2020年1月获得FDA批准开展I期临床。临床前研究显示,HW130具有显著的肿瘤血管破坏及降低肿瘤患者死亡率的作用,且对正常器官组织的损伤轻微。目前全球尚无同类抗肿瘤药物获批上市或处于临床前及临床研究不同阶段。
18F-APN-1607注射液是新旭医药研发的一种PET显像示踪剂,具有在多种Tau蛋白病变相关的疾病中造影出Tau蛋白变异的功能,目前该产品已在美国启动II期临床。此外,新旭医药已授权BMS旗下的新基公司在全球临床试验中使用该产品。
CYH33片是海和药物与中科院上海药物所共同开发的一款新型、高效、特异性的PI3Kα抑制剂。目前全球已有4款PI3K抑制剂获批上市,分别为吉利德/礼来的idelalisib、拜耳的copanlisib、武田的duvelisib以及诺华的alpelisib(BYL719),但在国内尚无该靶点药物获批。
罗氏的GDC-9545是一款选择性雌激素受体降解剂,拟开发用于ER阳性、HER2阴性局部晚期或转移性乳腺癌。GDC-9545是一款潜在的“best-in-class”新药,目前正在全球范围内开展III期临床试验。
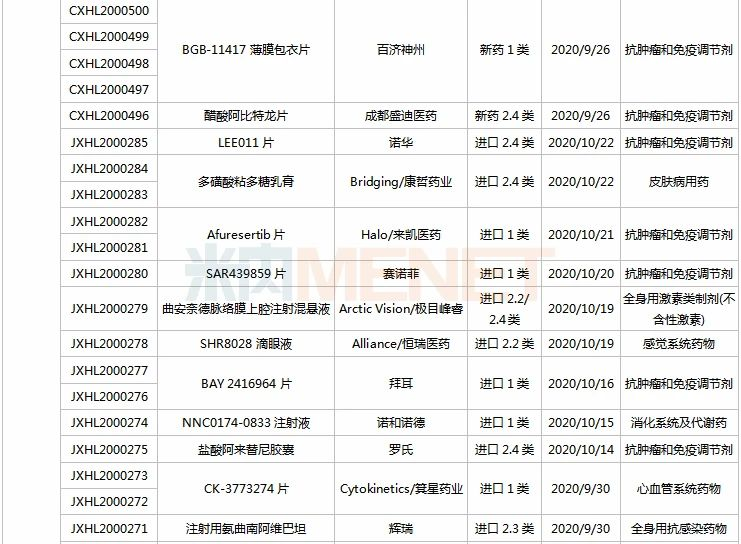
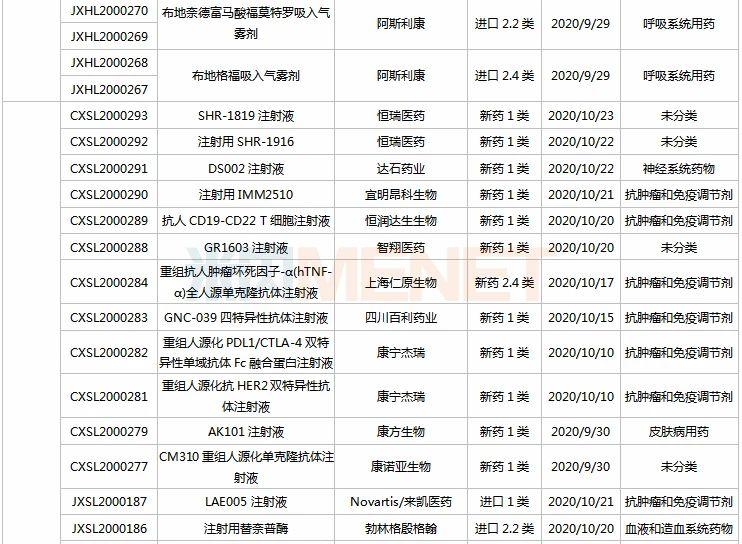
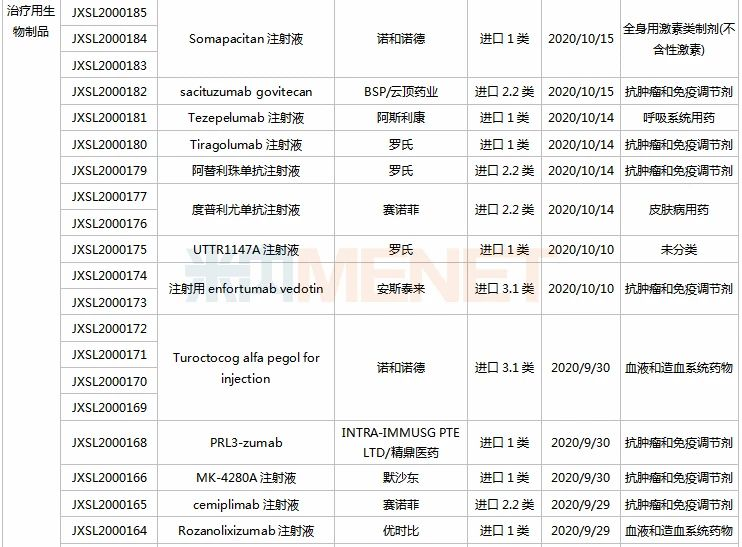
信立泰、恒瑞、江中.....72个新药临床申请获承办
9月26日-10月23日期间,72个新药(103个受理号)的临床申请获CDE承办受理,其中41个品种(59个受理号)为国产新药(33个为1类新药),31个品种(44个受理号)为进口新药。从药物类型看,化学药、治疗用生物制品、中成药分别有39个、30个、3个。
(9.26-10.23)承办的国产/进口新药临床申请
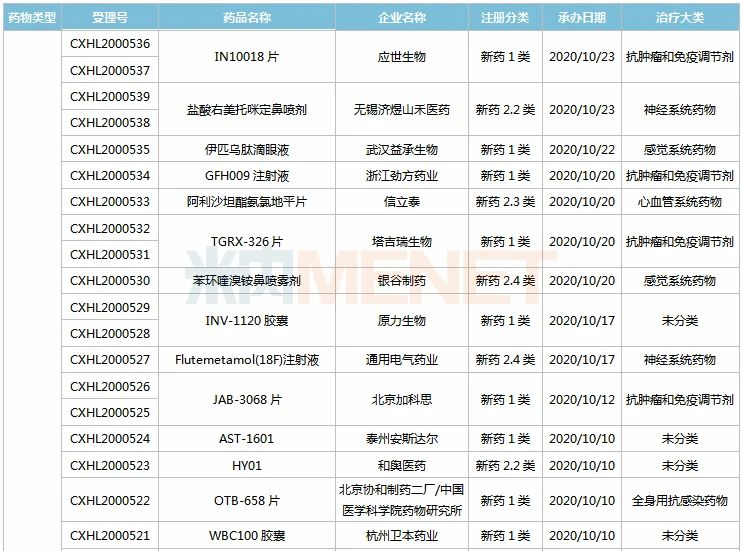
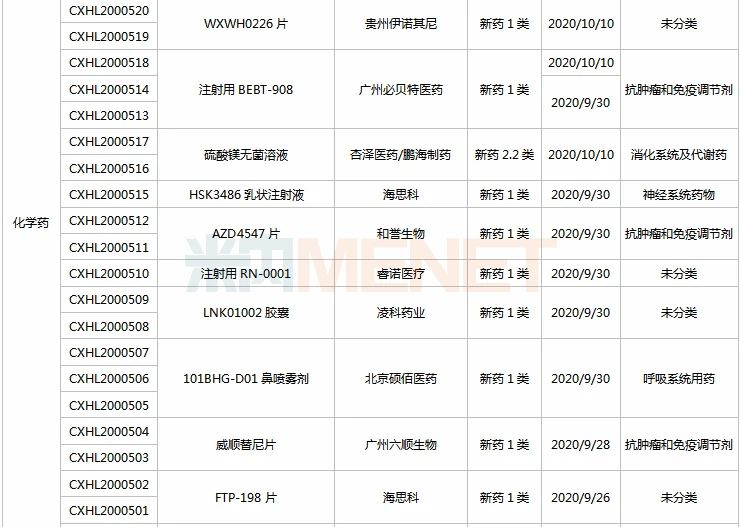
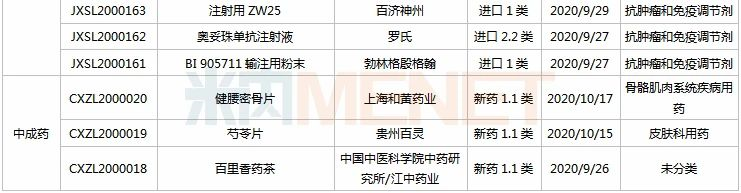 3款中成药1类新药首次在国内申请临床,分别为上海和黄药业的健腰密骨片(骨质疏松)、贵州百灵的芍苓片(银屑病)、中国中医科学院中药研究所/江中药业的百里香药茶。
3款中成药1类新药首次在国内申请临床,分别为上海和黄药业的健腰密骨片(骨质疏松)、贵州百灵的芍苓片(银屑病)、中国中医科学院中药研究所/江中药业的百里香药茶。
罗氏有5款新药申报临床,分别为盐酸阿来替尼胶囊(二代ALK抑制剂,已有适应症上市)、Tiragolumab注射液(TIGIT单抗)、阿替利珠单抗注射液(PD-L1单抗,已有适应症上市)、UTTR1147A注射液(IgG-4的融合蛋白)、奥妥珠单抗注射液,均非首次申报。
来凯医药递交两款1类新药临床试验申请,分别是PD-L1抗体新药LAE005注射液和泛AKT激酶抑制剂afuresertib片,这两款产品均从诺华引进,其中LAE005已在多种晚期癌症中完成I期临床,afuresertib目前正在中国和美国进行II期临床试验。
康宁杰瑞两款双抗新适应症申报临床,重组人源化PDL1/CTLA-4双特异性单域抗体Fc融合蛋白注射液(KN046)是国内研发进展最快的PDL1/CTA4单抗,晚期鳞状非小细胞肺癌适应症正在开展III期临床;重组人源化抗HER2双特异性抗体注射液(KN026)可有效识别两个不同的HER2表位,晚期胃及胃食管结合部癌、复发/转移性乳腺癌等适应症正在开展II期临床。
诺和诺德的Somapacitan注射液是一款每周皮下注射1次的长效人生长激素,与每日1次皮下注射生长激素的常规疗法相比,Somapacitan可提高用药依从性及治疗效果。该产品已于2020年9月获得FDA批准上市,此次为首次在中国申报临床。
注射用enfortumab vedotin是安斯泰来与Seattle Genetics联合开发的一款直接作用于Nectin-4的ADC药物。该产品于2019年12月获得FDA加速批准,用于治疗之前接受过PD-1/L1抑制剂并在手术之前或之后或在局部晚期或转移性背景下接受过含铂类化疗的成人局部晚期或转移性尿路上皮癌。
百济神州的BGB-11417薄膜包衣片是一款潜在同类最佳的Bcl-2抑制剂,有希望抑制维奈托克耐药突变。维奈托克是全球首个Bcl-2抑制剂,2019年全球销售额7.9亿美元,同比增长130%。此次为BGB-11417首次在国内提交临床申请,目前该产品已在澳大利亚启动I期临床,拟用于治疗成熟B细胞恶性肿瘤。
拜耳的BAY2416964片为强效、选择性和交叉反应性的芳香烃受体(AhR)抑制剂,能够发挥多种抗肿瘤免疫调节作用,属于新型免疫疗法。目前BAY2416964在全球范围内尚处于早期开发阶段,此次是拜耳首次在中国递交临床申请。
Tezepelumab注射液是安进和阿斯利康联合开发的胸腺基质淋巴细胞生成素(TSLP)抑制剂,是一款潜在的“first-in-class”新药,拟开发用于治疗哮喘、特应性皮炎等。Tezepelumab曾获FDA授予的突破性疗法认定,III期临床试验已经完成患者注册,预计2020年下半年获得结果。
数据来源:米内网数据库、CDE、公司公告
注:数据统计时间段为9月26日-10月23日,按药品名称统计(不含原料药、预防用生物制品、体外诊断试剂),如有疏漏,欢迎指正!