《国家食品药品监督管理总局关于征求加快解决药品注册申请积压问题的若干政策意见的公告》(2015年第140号)中,颇受争议的是一点就是——专利:“药品专利期届满前6年开始受理临床试验申请,前2年内开始受理生产申请。”
“44号文”虽然没提专利,但是药品注册法规里面还是有相关的专利申报要求。为此,我们有必要梳理一下药品专利的相关法规,理清因果关系。
妥协期法规:
为世贸而生
说起专利,需要先讲一下我国早期专利法的妥协——《药品行政保护条例》。
中国1985~1993年间的《专利法》不保护药品的知识产权,于是1992年12月颁布《药品行政保护条例》。1992年正是“十四大”正式提出“中国经济体制的目标是建立社会主义的市场经济”的那一年。同年2月,中国加入世贸组织的谈判重启,《药品行政保护条例》是在当时国际抗议下对药品知识产权的行政干预补救措施,其第一条就列明目的:“为了扩大对外经济技术合作与交流,对外国药品独占权人的合法权益给予行政保护,制定本条例”。该条例主要就是保护外国药品。
其中第四条指出“国务院药品生产经营行政主管部门受理和审查药品行政保护的申请,对符合本条例规定的药品给予行政保护,对申请人颁发药品行政保护证书”。第五条明确了申请行政保护的药品应当具备的条件:“(一)1993年1月1日前依照中国专利法的规定其独占权不受保护的;(二)1986年1月1日至1993年1月1日期间,获得禁止他人在申请人所在国制造、使用或者销售独占权的;(三)提出行政保护申请日前尚未在中国销售的”。可见,当年药监局已经可以对进口药的专利有行政保护权。
而对国内企业的最大限制是第十八条:“对获得行政保护的药品,未经药品独占权人许可,国务院卫生行政部门和省、自治区、直辖市的卫生行政部门不得批准他人制造或者销售”。
过渡期法规:
现已名存实亡
2000年CFDA颁布的《药品行政保护条例实施细则》(局令第25号),更是明确了药监局的职责,“国家药品监督管理局设立药品行政保护办公室,具体承担以下职责:(一)受理和审查药品行政保护申请、药品行政保护撤销申请、侵权处理申请;(二)提出授权或驳回的意见;(三)提出对药品行政保护撤销和侵权处理的意见;(四)设立登记簿,对药品行政保护的申请、授权、驳回、撤销、终止等事项进行登记;(五)对药品行政保护的受理、授权、驳回、撤销、终止等有关事宜进行公告;(六)办理与药品行政保护有关的其他工作”。
二十四条则对抢在原研药之前申报的产品有所放开,“在药品行政保护申请日前获准进行临床研究,且在药品行政保护授权日前经国家药品监督管理局批准生产的同一药品,在药品行政保护授权之后,可以在批准范围内继续生产、销售,但不得向第三方转让”。
随着2007年7月德国Roche Diagnostics GmbH的伊班膦酸(伊班膦酸钠一水合物)片剂和预充注射液在2012年1月17日终止了药品行政保护,再也没有药品获批,局令第25号实际上也已名存实亡。
现行法规:
更关注28号令
自2001年12月11日中国正式加入WTO后,遵守《与贸易有关的知识产权协议》要求,对申请市场许可而提交的含有新化学成分的药品未经披露的数据提供有效保护,保护期限为药品管理部门批准上市后的6年。
在2007年7月10日颁布的《药品注册管理办法》(局令第28号)第十九条有更明确的规定,“对他人已获得中国专利权的药品,申请人可以在该药品专利期届满前2年内提出注册申请。符合规定的,在专利期满后核发药品批准文号、《进口药品注册证》或者《医药产品注册证》”。对应140号文,140号文主要增加了临床申请在专利期届满前6年这个期限。
比如,按CFDA的“药品注册相关专利信息公开公示”数据库,普瑞巴林胶囊的专利为“其它专利”,无其它企业的专利,专利授权/公开日期为“2017-7-16”。重庆赛维药业有限公司以专利(CN200610054111.6)与辉瑞原研药有差别从而获批。
重庆赛维药业的这个专利涉及一种普瑞巴林缓释药物组合物,包含普瑞巴林或其可药用盐和至少一种释放速率控制材料的缓释药物组合物。该缓释组合物释放普瑞巴林的时间至少保持在10~24小时。该缓释药物组合物主要用于治疗中枢神经系统疾病,如癫痫、焦虑症、神经性疼痛(糖尿病和疱疹所致的疼痛)等,申请的适应症为广泛性焦虑障碍、糖尿病性外周神经病、疱疹后神经痛、纤维肌痛综合征、癫痫的辅助治疗。而辉瑞的适应症为治疗带状疱疹后神经痛。
通过专利规避获批的最近案例还有正大天晴的达沙替尼。BMS的达沙替尼使用的水合物晶型H1-7没有在中国申请无水晶型N-6的专利保护,正大天晴为了规避原研药的专利保护,采取晶型N-6进行开发。
重提72条:
抢仿更需看原研上市时间
实际上,对于抢仿制药申报的企业来说,除了专利保护,还需要了解新药保护的另外一个概念——《药品注册管理办法》中的“新药监测期”。“监测期自新药批准生产之日起计算,最长不得超过5年。监测期内的新药,国家食品药品监督管理局不批准其他企业生产、改变剂型和进口”。
值得注意的是,《药品注册管理办法》第70条和第72条,“新药进入监测期之日起,已经批准其他申请人进行药物临床试验的,可以按照药品注册申报与审批程序继续办理该申请,符合规定的,批准该新药的生产或者进口,并对境内药品生产企业生产的该新药一并进行监测”和“进口药品注册申请首先获得批准后,已经批准境内申请人进行临床试验的,可以按照药品注册申报与审批程序继续办理其申请,符合规定的,批准其进行生产;申请人也可以撤回该项申请,重新提出仿制药申请。对已经受理但尚未批准进行药物临床试验的其他同品种申请予以退回,申请人可以提出仿制药申请”。
最近阿昔替尼被退审,其实与140号文所提及的专利限制申请无关,而主要与72条相关。辉瑞的阿昔替尼片在今年4月29日获批1mg和5mg两个规格,因而排队2年报批临床还是赶不上原研排队1年的报批生产速度的各厂家们只好“杯具”了。
头脑风暴<<<
“140号文”引发的专利思考
药品的专利目前其实更多不是用在注册,而是用在药品招标采购中“专利层次”争取独家或少家的竞争位置,以及为了满足各种基金申报或高新资质认证中对专利数量的要求。药品招标采购中的“专利层次”也罢,140号文所提及的“受《中华人民共和国专利法》保护并在专利期内的药品”也罢,CFDA认可的针对药品专利保护究竟是以我国专利局查询的专利,还是以CFDA“药品注册相关专利信息公开公示”中提供的专利,暂时没有一个统一的官方答案。
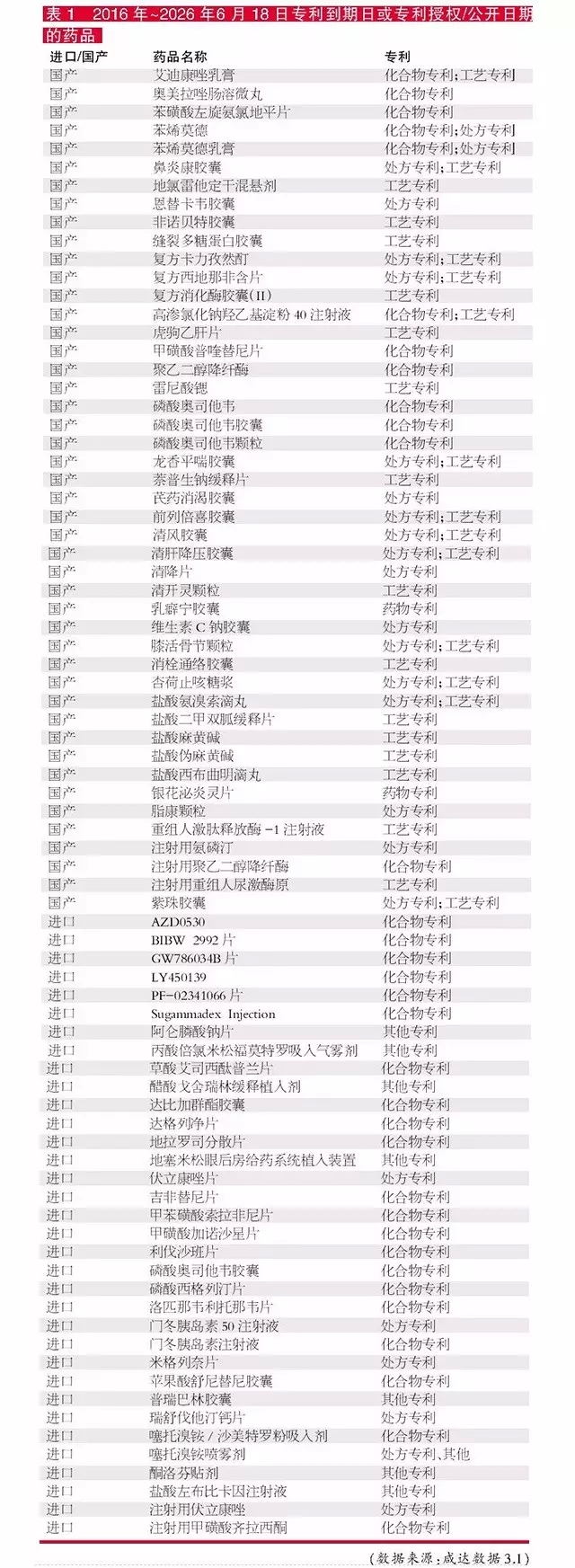
根据咸达数据V3.1对CFDA的“药品注册相关专利信息公开公示”的监测,“专利到期日或专利授权/公开日期”,2016年至2026年6月18日共涉及79个药品名,对应138个受理号。CFDA的“药品注册相关专利信息公开公示”数据库,只有如“工艺专利、处方专利、化合物专利”的分类查询结果,更细化的晶型专利并没有标明,更没有相关的专利号,查询非常不便。而且“专利到期日或专利授权/公开日期”中,2008年前受理的品种为“专利到期日”,2008年后受理的品种为“专利授权/公开日期”,对于专利究竟何时才到期,不方便做出判断。
我国目前懂专利的人才非常稀缺,国内厂家大部分擦边球型的专利,主要是应付药品招标采购和基金申报,其真实性和创新性经不起推敲。预计未来关于专利纠纷的案例会越来越多,这种案例更多会外包给专业的知识产权第三方去负责。跨国企业在越来越清晰国内专利法规的边界后,对保护自己的专利越来越有经验,专利防御或许会更严谨,国内企业挑战的难度必然增加。
若“140号令”最终得以通过,未来有能力绕开专利的厂家将会在限期前提前申报;没有能力的小厂家由于不知道销售规模较大的药品的整体研发情况,从而在解禁期同一天盲目扎堆排队申报,导致另外一种无意义的重复申报,还有待时间证明。