各有关单位:
在新版 GMP 中被多次强调后,许多制药企业即陷入“法规要求必须一致”与“客观上就是无法一致”这一近乎绝望的无奈中难以自拔,基层制药人在持续作假与诚信执业的交集中,经受着“身心”上的折磨和摧残,因为许多药品按照注册工艺确实生产不出合格产品。故生产工艺与注册工艺不一致需要补充申请。为了使药品申报工艺与生产工艺一致性更好的结合,了解补充申请实施过程中遇到的疑点、难点问题,切实保障药品的质量。经研究,全国医药技术市场协会定于2015年11月19日--21日在成都市举办“药品注册申报工艺与生产工艺一致性研究及补充申请申报培训班”,请你单位积极选派人员参加。现将有关事项通知如下:
一、会议安排
会议时间:2015年11月19日-21日 (19日全天报到)
报到地点:成都市 (具体地点直接发给报名人员)
二、会议主要交流内容
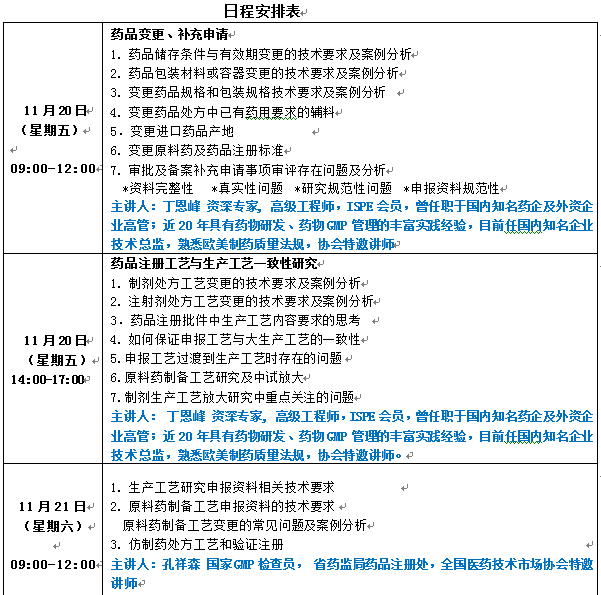
详见附件(日程安排表)
三、参会对象
从事中药生产企业的GMP管理、QC管理、验证专员、仪器验证工程师、QA经理、QA审计员、稳定性试验专员、校验工程师、工程部管理、设备部管理、生产管理、注册管理等相关人员。
四、会议说明
1、理论讲解,实例分析,专题讲授,互动答疑.
2、主讲嘉宾均为全国医药技术市场协会GMP工作室专家,新版GMP标准起草人,检查员和行业内GMP资深专家、欢迎来电咨询,课后及时跟踪辅导。
3、完成全部培训课程者由全国医药技术市场协会颁发培训证书
4、企业需要内训和指导,请与会务组联系
五、会议费用
会务费:1980元/人(会务费包括:培训、研讨、资料等)。食宿统一安排,费用自理。
六、联系方式
联 系 人:刘松 电话:18511832590
传 真:010-53032745 邮箱:bjliu1983@
会议质量监督电话:010-51606480 张 岚
附件: